-
据科学家预测,月球的土壤中吸附着数百万吨的He,每百吨He核聚变所释放出的能
量相当于目前人类一年消耗的能量。在地球上,氦元素主要以He的形式存在。下列说法正确的是( )
A.
原子核内含有4个质子
B.
和
互为同位素
C.
原子核内含有3个中子
D.
的最外层电子数为2,所以
具有较强的金属性
难度: 中等查看答案及解析
-
关于离子键、共价键的各种叙述中,下列说法中正确的是( )
A.在离子化合物中,只存在离子键,没有共价键
B.由不同元素组成的多原子分子里,一定只存在极性键
C.非极性键只存在于双原子的单质分子中
D.在共价化合物分子内,一定不存在离子键
难度: 中等查看答案及解析
-
短周期元素中,A元素原子最外层电子数是次外层电子数的2倍;B元素原子最外层电子数是其内层电子总数的3倍;C元素原子M层电子数等于其L层电子数的一半;D元素原子最外层有1个电子,D的阳离子与B的阴离子电子层结构相同,则4种元素原子序数关系中正确的是( )
A.C>D>B>A B.D>B>A>C C.A>D>C>B D.B>A>C>D
难度: 简单查看答案及解析
-
根据下表信息,判断以下叙述正确的是( )部分短周期元素的原子半径及主要化合价
元素代号
L
M
Q
R
T
原子半径/nm
0.166
0.143
0.112
0.104
0.066
主要化合价
+2
+3
+2
+6、-2
-2
A.氢化物的沸点为H2T<H2R B.L的金属性比M强
C.单质与稀盐酸反应的速率为L<Q D.L2+与R2-的核外电子数相等
难度: 简单查看答案及解析
-
短周期中三种元素a、b、c在周期表中的位置如图,下列有关这三种元素的叙述正确的是( )
A.a是一种活泼的非金属元素
B.c的最高价氧化物的水化物是一种弱酸
C.b的氢化物很稳定
D.b元素的最高化合价为+7价
难度: 简单查看答案及解析
-
已知X、Y、Z是三种原子序数相连的元素,最高价氧化物对应水化物酸性相对强弱的顺序是HXO4>H2YO4>H3ZO4,则下列判断正确的是( )
A.气态氢化物的稳定性:HX>H2Y>ZH3
B.非金属活泼性:Y<X<Z
C.原子半径:X>Y>Z
D.原子最
外层电子数:X<Y<Z
难度: 简单查看答案及解析
-
四种主族元素的离子aXm+、bYn+、cZn-和dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,则下列叙述正确的是( )[
①a-b=n-m ②元素的原子序数:a>b>c>d ③元素非金属性:Z>R ④最高价氧化物对应的水化物的碱性:X>Y
A.只有③ B.①②③④ C.①②③ D.②③
难度: 简单查看答案及解析
-
下列反应一定属于放热反应的是( )
A.氢氧化钡晶体和氯化铵晶体的反应
B.能量变化如图所示的反应
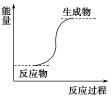
C.化学键断裂吸收的能量比化学键形成放出的能量少的反应
D.不需要加热就能发生的反应
难度: 简单查看答案及解析
-
已知2 mol氢气完全燃烧生成水蒸气时放出能量484 kJ,且氧气中1 mol O===O键完全断裂时吸收能量496 kJ,水蒸气中1 mol H—O键形成时放出能量463 kJ,则氢气中1 mol H—H键断裂时吸收能量为( )
A.920 kJ B.557 kJ C.188 kJ D
. 436 kJ
难度: 中等查看答案及解析
-
2012年6月16日18时37分24秒,神舟九号成功发射。飞船的能量部分来自太阳能电池,另外内部还配有高效的MCFC型燃料电池。该燃料电池可同时供应电和水蒸气,其所用燃料为氢气
,电解质为熔融的碳酸钾。已知该燃料电池的总反应为2H2+O2===2H2O,负极反应为H2+CO32--2e-===CO2↑+H2O,则下列推断正确的是( )
A.电池放电时,电子经外电路由通氧气的正极流向通氢气的负极
B.电池工作时CO32-向负极移动
C.正极的电极反应式为4OH--2e-===O2↑+2H2O
D.通氧气的电极为正极,发生氧化反应
难度: 简单查看答案及解析