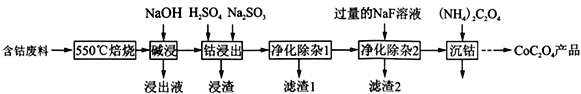
-
我国古代文明中包含着丰富的化学知识。下列没有发生电子转移的是( )
A. 铁石制成指南针 B. 爆竹声中一岁除 C. 西汉湿法炼铜 D. 雷雨发庄稼
难度: 简单查看答案及解析
-
NA 为阿伏加德罗常数的值,下列有关叙述正确的是
A. 1.6 g O2 和O3 的混合物含有的分子数目为0.1 NA
B. 足量的Mg 与0.1mol CO2 充分反应,转移的电子数目为0.4 NA
C. 25℃时,pH=2 的H2SO4溶液中含有的H+数目为0.02 NA
D. 标准状况下,1.12L 三氯甲烷(CHCl3)含有的化学键数目为0.2 NA
难度: 中等查看答案及解析
-
我国自主研发对二甲苯的绿色合成路线示意图如下:
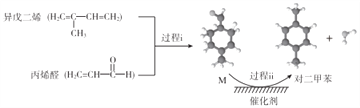
下列说法正确的是( )
A. 过程ⅰ发生了取代反应 B. 中间产物M的结构简式为

C. 利用相同原料、相同原理也能合成邻二甲苯 D. 该合成路线理论上碳原子的利用率为100%
难度: 简单查看答案及解析
-
氯化锌易潮解,实验室依次采用除水(氯化氢气体“置换”)、升华相结合的方法,从市售的氯化锌[含Zn(OH)Cl]制备无水氯化锌,装置如下图所示。下列说法错误的是( )
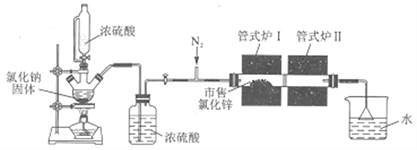
A. 恒压滴液漏斗、倒置漏斗的作用分别是平衡气压、防止倒吸
B. 实验中利用了浓硫酸的高沸点性、酸性和吸水性
C. 在尾气吸收装置前应增加一个盛有浓硫酸的洗气瓶
D. 管式炉Ⅰ采取阶段式升温,实验结束时先撤去管式炉Ⅰ、再撤去管式炉Ⅱ
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,Y原子的电子层数和最外层电子数相同,Z单质可制成半导体材料,W与X位于同一主族。下列叙述正确的是( )
A. 简单离子的半径:Y>W B. Y和Z的单质均能与强碱溶液反应生成氢气
C. 最高价氧化物对应的水化物的酸性:Z>W D. 简单气态氢化物的热稳定性:W>X
难度: 中等查看答案及解析
-
下图为利用肼(N2H4)一空气燃料电池电解硫酸铜溶液的示意图。下列说法正确的是( )

A. 左图中离子交换膜为阳离子交换膜
B. 左图负极反应式为:N2H4-6e-+4OH-=N2↑+4H2O
C. 闭合开关K一段时间后,左图电池中电解质溶液的pH不变
D. 当右图阴极上析出4.48L气体(标准状况)时,消耗0.15molN2H4
难度: 中等查看答案及解析
-
室温下,某碳酸溶液中的H2CO3、HCO3-、CO23-的物质的量分数δ随pH的变化如下图所示。下列叙述错误的是( )
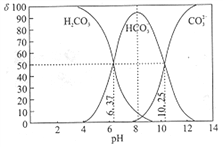
A. 当溶液中δ(HCO3-)达到最大时:c(H2CO3)>c(CO32-)
B. Ka2(H2CO3)的数量级为10-11
C. 调节溶液的pH由8~10的过程中
减小
D. 加入NaOH使溶液pH=9时,主要反应为HCO3-+OH-=CO32-+H2O
难度: 中等查看答案及解析


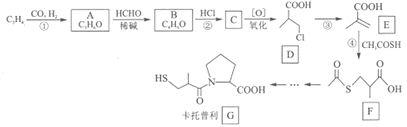
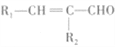 (R1、R2代表氢原子或烃基)。
(R1、R2代表氢原子或烃基)。