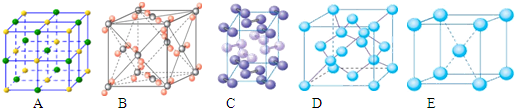
-
下列各组物质中化学键的类型相同的是( )
A.HCl MgCl2 NH4Cl
B.H2O Na2O CO2
C.CaCl2 NaOH H2O
D.NH3 H2O CO2难度: 中等查看答案及解析
-
下列化学用语表达正确的是( )
A.N2的结构式::N≡N:
B.NaCl的电子式:
C.CO2的分子模型示意图:
D.F-的结构示意图:难度: 中等查看答案及解析
-
下列说法正确的是( )
A.H与D互为同位素;金刚石、石墨和C60互为同素异形体;甲醇、乙二醇和丙三醇互为同系物
B.由ⅠA族和ⅥA族元素形成的原子个数比为1:1、电子总数为38的化合物,是含有共价键的离子化合物
C.金属晶体、离子晶体和分子晶体都能导电
D.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键难度: 中等查看答案及解析
-
下列有关说法正确的是( )
A.根据电离方程式HCl=H++Cl-,判断HCl分子里存在离子键
B.分子晶体的堆积均为分子密堆积
C.NCl3分子中,原子的最外层电子都满足了8电子稳定结构
D.在水中氢、氧原子间均以化学键相结合难度: 中等查看答案及解析
-
下列物质的熔、沸点高低顺序中,正确的是( )
A.MgO>CaO,NaCl>KCl
B.HI>HBr>HCl>HF
C.金刚石>晶体硅>碳化硅
D.纯铁>铁铝合金>Rb>K>Na难度: 中等查看答案及解析
-
下列有关说法正确的是( )
A.含阳离子的化合物一定有阴离子
B.晶格能由大到小:NaF>NaCl>NaBr>NaI
C.含有共价键的晶体一定具有高的熔、沸点及硬度
D.空间利用率:面心立方>六方密堆积>体心立方难度: 中等查看答案及解析
-
现有四种元素基态原子电子排布式如下:①1s22s22p63s23p4; ②1s22s22p63s23p3;③1s22s22p3; ④1s22s22p5.则下列有关比较中正确的是( )
A.第一电离能:④>③>②>①
B.原子半径:②>①>④>③
C.电负性:④>③>②>①
D.最高正化合价:④>①>③=②难度: 中等查看答案及解析
-
下列现象与氢键有关的是( )
①乙醇可以和水以任意比互溶
②冰的密度比液态水的密度小
③氨易液化
④水分子高温下也很稳定
⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
⑥乙硫醇(CH3CH2-SH)比乙醇(CH3CH2-OH)的熔点低的原因是乙醇分子间易形成氢键.
A.①②⑤
B.①②③⑤⑥
C.①②⑤⑥
D.①②③难度: 中等查看答案及解析
-
电子由2p能级跃迁至3s能级时,可通过光谱仪直接摄取的是( )
A.电子的运动轨迹图象
B.原子的吸收光谱
C.电子体积大小的图象
D.原子的发射光谱难度: 中等查看答案及解析
-
下列说法中错误的是( )
A.电子排布式1s22s22p63s23p63d3违反了能量最低原理
B.6C的电子排布式1s22s22px2违反了洪特规则
C.同一原子中一定没有能量相同的电子
D.电子排布式1s22s22p63s23p10违反了泡利原理难度: 中等查看答案及解析
-
下列分子,中心原子的杂化类型和分子的极性均与乙烯C2H4相同的是( )
A.BCl3
B.H2O
C.CH4
D.SO2难度: 中等查看答案及解析
-
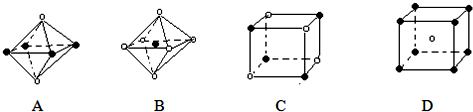
某离子晶体的晶体结构中最小重复单元如图所示:A为阴离子,在正方体内,B为阳离子,分别在顶点和面心,则该晶体的化学式为( )
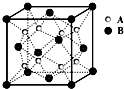
A.B2A
B.BA2
C.B7A4
D.B4A7难度: 中等查看答案及解析
-
以NA表示阿伏加德罗常数,下列说法正确的是( )
A.124 g P4含有P-P键的个数为4NA
B.1mol冰含氢键数为4NA
C.22.4L C2H2中有2NA个π键
D.1mol二氧化硅晶体中含Si-O键数为4NA难度: 中等查看答案及解析
-
下列物质发生变化时,所克服的粒子间相互作用属同种类型的是( )
A.碘与干冰分别受热变为气体
B.硝酸铵与硝酸分别受热变为气体
C.氯化钠与氯化氢分别溶解在水中
D.晶体汞与冰分别受热熔化难度: 中等查看答案及解析
-
最近,意大利科学家使用普通氧分子和带正电荷的氧离子制造出了由4个氧原子构成的氧分子,并用质谱仪探测到了它存在的证据.若该氧分子具有空间对称结构,下列关于该氧分子的说法正确的是( )
A.是一种新的氧化物
B.不可能含有极性键
C.是氧元素的一种同位素
D.是臭氧的同分异构体难度: 中等查看答案及解析
-
有且只有一个手性碳的有机分子为手性分子,下列有机物分子中属于手性分子的是( )
①新戊烷[(CH3)4C]②乳酸[CH3CH(OH)COOH]③甘油 ④
A.①②③
B.②和④
C.①和③
D.②③④难度: 中等查看答案及解析
-
下列有关含氧酸的说法中正确的是( )
A.元素的非金属性越强,其含氧酸的酸性就越强
B.含氧酸中有多少个H原子,就属于几元酸
C.同一元素的不同含氧酸,非羟基氧越多,该酸的酸性越强
D.含氧酸中,中心原子的化合价越高,其氧化性一定越强难度: 中等查看答案及解析
-
短周期元素X的原子最外电子层中具有最多的未成对电子,元素Y的原子只有两种形状的电子云,且两种电子云的电子数相等,则X、Y组成的微粒中不可能存在的是( )
A.XY42-
B.X2Y5
C.XY2-
D.XY3-难度: 中等查看答案及解析
-
X、Y、Z均为第三周期元素,X的第一电离能在同周期中最小,Y的电负性在同周期中最大,Z的离子半径在同周期中最小,下列关于X、Y、Z叙述不正确的是( )
A.元素Y形成的气态氢化物极易溶于水,水溶液呈强酸性
B.元素X与元素Y能形成离子化合物
C.元素Z最高价氧化物对应水化物既能与强酸反应,又能与强碱
D.原子序数和原子半径大小顺序均为:X<Y<Z难度: 中等查看答案及解析
-
配位化合物Pt(NH3)2Cl2有顺铂和反铂两种同分异构体.顺铂在水中的溶解度较大,具有抗癌作用;反铂在水中的溶解度小,无抗癌作用.(Pt的中子数为117,质量数为195).下列说法正确的是( )
A.N原子杂化方式为sp2杂化
B.分子中Pt和N之间为离子键
C.已知Pt位于周期表第十纵行,则Pt是d区的VIIIB族元素
D.顺铂在苯等有机溶剂中溶解度小于反铂难度: 中等查看答案及解析
-
二茂铁分子[Fe (C5H5)2]是一种金属有机配合物,是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等.它的结构如图所示,下列说法正确的是( )
A.二茂铁中Fe2+与环戊二烯离子(C5H5-)之间为离子键
B.Fe元素在周期表中的位置是第四周期ⅧA
C.Fe2+的电子排布式为1s22s22p63s23p63d6
D.1mol环戊二烯()中含有σ键的数目为5NA,π键的数目是2NA
难度: 中等查看答案及解析
-
“笑气”(N2O)是人类最早的医疗麻醉剂之一.有关理论认为N2O与CO2分子具有相似的结构(包括电子式);已知N2O分子中氧原子只与一个氮原子相连,下列说法合理的是( )
A.N2O与SiO2为等电子体、具有相似的结构
B.N2O的电子式可表示
C.N2O与CO2均不含非极性键
D.N2O为三角形分子难度: 中等查看答案及解析
-
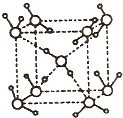
如图所示的是某原子晶体A空间结构的一个单元,A与某物质B反应生成C,其实质是每个A-A键中插入一个B原子,则C物质的化学式为( )
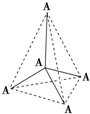
A.AB
B.AB4
C.AB2
D.A2B5难度: 中等查看答案及解析
-
2008年的秋天,毒奶粉事件震惊全国,这主要是奶粉中含有有毒的三聚氰胺(分子结构如图所示).下列关于三聚氰胺分子的说法中正确的是( )
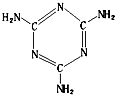
A.三聚氰胺的分子式为C3N3H6
B.形成的晶体熔点较高
C.属于极性分子,故极易溶于冷水
D.所有碳原子都采用sp2杂化难度: 中等查看答案及解析
-
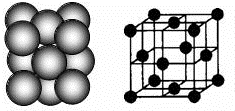
CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中含有的中哑铃形C22-的存在,使晶胞沿一个方向拉长.下列关于CaC2晶体的说法中正确的是( )
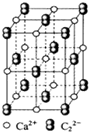
A.1个Ca2+周围距离最近且等距离的C22-数目为6
B.6.4克CaC2晶体中含阴离子0.1mol
C.该晶体中的阴离子与F2是等电子体
D.与每个Ca2+距离相等且最近的Ca2+共有12个难度: 中等查看答案及解析