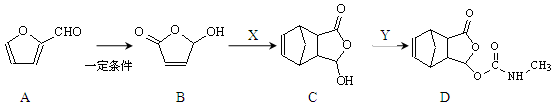-
不能通过化学反应实现的是
A.生成一种新离子 B.生成一种新分子
C.生成一种新原子 D.生成一种新物质
难度: 中等查看答案及解析
-
符号“3px”没有给出的信息是
A.电子层 B.电子亚层
C.电子云在空间的伸展方向 D.电子的自旋方向
难度: 简单查看答案及解析
-
石油裂化的主要目的是为了
A.提高轻质液体燃料的产量 B.便于分馏
C.获得短链不饱和气态烃 D.提高汽油的质量
难度: 简单查看答案及解析
-
为防止有机物挥发,可加一层水保存,即水封。下列有机物中,既能用水封法保存,又能发生水解和消去反应的是
A.乙醇 B.溴乙烷 C.乙酸乙酯 D.四氯化碳
难度: 中等查看答案及解析
-
实验表明,相同温度下,液态纯硫酸的导电性强于纯水。下列关于相同温度下纯硫酸的离子积常数K和水的离子积常数Kw关系的描述正确的是
A.K> Kw B.K= Kw C.K< Kw D.无法比较
难度: 简单查看答案及解析
-
下列过程中,共价键被破坏的是
A.碘升华 B.溴蒸气被木炭吸附
C.酒精溶于水 D.氯化氢气体溶于水
难度: 简单查看答案及解析
-
在铜的催化作用下氨气与氟气反应,得到一种三角锥形分子M和一种铵盐N。下列有关说法错误的是
A.该反应的化学方程式为4NH3+3F2→ NF3+3NH4F
B.M是极性分子,其还原性比NH3强
C.M既是氧化产物,又是还原产物
D.N中既含有离子键,又含有共价键
难度: 中等查看答案及解析
-
将反应 4(NH4)2SO4→ N2↑+6NH3↑+3SO2↑+SO3↑+7H2O 的产物气体通入BaCl2溶液,下列判断正确的是
A.无沉淀生成 B.肯定没有BaSO3生成
C.得到的沉淀是纯净物 D.得到的沉淀是BaSO4和BaSO3组成的混合物
难度: 中等查看答案及解析
-
NO2存在下列平衡:2NO2(g)
N2O4(g)+Q(Q>0) 在测定NO2的相对分子质量时,下列条件下测定结果最接近理论值的是
A.温度130℃、压强3.03×105 Pa B.温度25℃、压强1.01×105 Pa
C.温度130℃、压强5.05×104 Pa D.温度0℃、压强5.05×104 Pa
难度: 中等查看答案及解析
-
将表面发黑(黑色物质为Ag2S)的银器按下图方法处理,一段时间后银器光亮如新。下列说法正确的是
A.铝质容器为正极,银器为负极
B.反应前后银器质量不变
C.Ag2S被还原生成单质银
D.总反应为2Al+3Ag2S → 6Ag+ Al2S3
难度: 中等查看答案及解析
-
室温下有下列四种溶液:①0.1 mol/L氨水 ②0.1 mol/L NH4Cl溶液 ③混合溶液:盐酸和NH4Cl的浓度均为0.1 mol/L ④混合溶液:NaOH和氨水的浓度均为0.1 mol/L。四种溶液中c(NH4+)由大到小排列正确的是
A.②③④① B.②①③④ C.③②④① D.③②①④
难度: 中等查看答案及解析
-
测定CuSO4∙nH2O的结晶水含量,方法是:称量样品→ 在坩埚中加热→ 冷却→ 称量无水盐。若用相同方法测试下列晶体中的结晶水含量,可行的是
A.Cu(NO3)2∙nH2O B.MgCl2∙nH2O C.MgSO4∙nH2O D.FeSO4∙nH2O
难度: 中等查看答案及解析
-
氢化亚铜(CuH)是一种不稳定物质,能在氯气中燃烧;也能与酸反应。用CuSO4溶液和“某物质”在40~50℃时反应可产生它。下列有关叙述中错误的是
A.“某物质”具有还原性
B.CuH与盐酸反应,可能产生H2
C.CuH与足量的稀硝酸反应:CuH+ 3H++ NO3-→ Cu2++ NO↑+ 2H2O
D.CuH在氯气中燃烧:CuH+ Cl2→ CuCl+ HCl
难度: 中等查看答案及解析
-
关于反应Zn+ 2HNO3+ NH4NO3→ N2↑+ 3H2O+ Zn(NO3)2,下列判断正确的是
A.生成1 mol N2,电子转移总数为3NA B.生成1 mol N2,电子转移总数为5NA
C.溶解1 mol Zn,电子转移总数为2NA D.溶解1 mol Zn,电子转移总数为4NA
难度: 中等查看答案及解析
-
如图,将2 mL浓度为6 mol/L的盐酸用注射器通过橡皮塞慢慢注入,玻璃管中出现小气泡,气泡在溶液中逐渐上升的过程中消失。对该反应过程的推断不合理的是:

A.有反应CO32- + 2H+ → CO2↑ + H2O发生
B.有反应CO32- + H+ → HCO3-发生
C.有反应CO32- + CO2 + H2O→ 2HCO3-发生
D.加快盐酸注入速度不会改变反应现象
难度: 中等查看答案及解析
-
有一瓶乙二醇和丙三醇的混合物,它们的性质如下表。则将乙二醇和丙三醇互相分离的最佳方法是
物质
分子式
熔点/℃
沸点/℃
密度/g·cm-1
溶解性
乙二醇
C2H4O2
-11.5
198
1.11
易溶于水和乙醇
丙三醇
C3H8O3
17.9
290
1.26
能跟水、酒精以任意比互溶
A.分液 B.蒸馏 C.冷却至0℃后过滤 D.加水萃取
难度: 中等查看答案及解析
-
为了测定某铜银合金成分,将30 g合金完全溶于80 mL 13.5 mol/L的浓硝酸中,待反应完全后,收集到0.3 mol气体,并测得溶液中c(H+)是1 mol/L。假设反应后溶液体积仍为80 mL,则合金中银的质量分数为
A. 36% B.66.3% C. 78.7% D.96.6%
难度: 中等查看答案及解析
-
甲基丙烯酸甲酯是世界上年产量超过100万吨的高分子单体.旧法合成的反应是:
(CH3)2C=O+HCN → (CH3)2C(OH)CN
(CH3)2C(OH)CN+CH3OH+H2SO4 → CH2=C(CH3)COOCH3+ NH4HSO4
90年代新法的反应是:CH3C≡CH+ CO+ CH3OH → CH2=C(CH3)COOCH3
与旧法比较,新法的优点是:
A.原料无爆炸危险 B.没有副产物,原料利用率高
C.原料都是无毒物质 D.对设备腐蚀性较小
难度: 中等查看答案及解析
-
已知:Ki1(H2CO3)> Ki1(H2S)。现有以下试剂:盐酸、醋酸、苯酚、碳酸钙、醋酸钠溶液、硫化钠溶液,用下图所示装置进行下列实验,无法达到实验目的的是

A.比较醋酸、苯酚、碳酸的酸性
B.比较盐酸、醋酸、碳酸的酸性
C.比较醋酸、氢硫酸、碳酸的酸性
D.比较盐酸、碳酸、氢硫酸的酸性
难度: 中等查看答案及解析
-
室温下,0.01 mol/L 二元酸H2A溶液的pH= 3,下列说法正确的是
A.在Na2A,NaHA两种溶液中,离子种类相同
B.NaHA溶液的pH一定大于7
C.在NaHA溶液中一定有c(OH-)+ c(A2-) = c(H2A)+ c(H+)
D.在溶质的物质的量相等的Na2A,NaHA两种溶液中,阴离子总数相等
难度: 困难查看答案及解析
-
某溶液可能含有Na+ 、Ag+、Al3+、S2-、CO32-、SO32-、NO3-等离子中的数种。向此溶液中加入稀盐酸,有浅黄色沉淀和气体出现,此溶液的焰色为黄色。根据以上实验现象,下列关于原溶液中离子成分的推测正确的是
A.一定有S2-、SO32-、Na+ B.可能只有Na+、S2-、CO32-
C.一定没有Ag+、Al3+ D.可能只有Na+、S2-、NO3-
难度: 中等查看答案及解析
-
在300℃时,改变起始反应物中n(H2)对反应N2(g) + 3H2(g)
2NH3(g)+Q(Q>0)的影响如右图所示。下列说法正确的是

A.反应在b点达到平衡
B.b点H2的转化率最高
C.c点N2的转化率最高
D.a、b、c三点的平衡常数Kb > Ka > Kc
难度: 中等查看答案及解析