-
下列有机物的命名正确的是( )
A.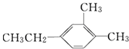
1,6-二甲基-4-乙苯
B.
3-乙基-1-丁烯
C.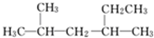
2,4-二甲基己烷
D.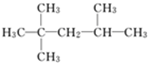
2,2,3-三甲基戊烷难度: 中等查看答案及解析
-
在中和滴定操作过程中,以下各项因操作不当引起实验结果偏低的是( )
A.滴定管用蒸馏水洗净后,未用已知浓度的标准溶液润洗
B.锥形瓶用蒸馏水洗净后,又用待测溶液润洗
C.滴定前平视,滴定终了俯视
D.滴定管(装标准溶液)在滴定前尖嘴处有气泡,滴定终了无气泡难度: 中等查看答案及解析
-
下列关于原电池和电解池的说法正确的是( )
A.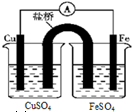
如图所示,把盐桥换为铜导线也可以形成原电池
B.电解饱和食盐水制烧碱,用碳钢网作阳极
C.白铁是在铁上电镀锌,用锌作阳极,铁作阴极
D.电解法精炼粗铜时,电解质溶液CuSO4溶液浓度不变难度: 中等查看答案及解析
-
下列有机物①CH2=CH2;②CH3CH2Br;③C2H5OH;④
;⑤CCl4;⑥
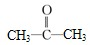 ;
;
⑦;⑧
据官能团的不同可分为( )
A.5类
B.6类
C.7类
D.8类难度: 中等查看答案及解析
-
25℃时,水的电离达到平衡:H2O⇌H++OH-;△H>0,下列叙述正确的是( )
A.向水中加入稀醋酸,平衡逆移,c(H+)降低
B.将水加热,KW增大,pH不变
C.向水中加入少量固体硫酸氢钾,c(H+)增大,KW不变
D.pH=10的NaOH溶液与pH=10的NaClO溶液中,水电离c(H+)之比等于106难度: 中等查看答案及解析
-
相同材质的铁在下列情形下最不易被腐蚀的是( )
A.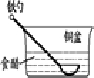
B.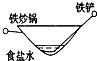
C.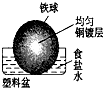
D.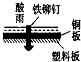
难度: 中等查看答案及解析
-
下列有关热化学方程式的叙述正确的是( )
A.反应物的总能量高于生成物的总能量时,该反应常温下即可发生
B.氢气燃烧热为285.8kJ•mol-1,则有H2(g)+1/2O2(g)=H2O(g)△H=-285.8kJ•mol-1
C.将1molBa(OH)2的稀溶液与稀盐酸完全中和,放出114.6kJ的热量,热化学方程式为:OH-(aq)+H+(aq)=H2O(l)△H=-114.6kJ•mol-1
D.2SO2(g)+O2(g)⇌2SO3(g);△H=-QkJ•mol-1(Q>0),则将2molSO2(g)和足量O2置于一密闭容器中,充分反应后放出的热量一定小于QkJ难度: 中等查看答案及解析
-
LiFePO4可用于电动汽车.电池反应为:FePO4+Li
LiFePO4,电解质为导电固体.下列有关LiFePO4电池的说法正确的是( )
A.该电池可用水作电解质溶液
B.充电时,电池内部的Li+向阳极移动
C.充电阳极反应LiFePO4-e-=FePO4+Li+
D.放电时正极材料的质量减少难度: 中等查看答案及解析
-
在一定条件下,将3mol A和1mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)⇌xC(g)+2D(g).2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol•L-1.下列判断正确的是( )
A.A的转化率为40%
B.2 min内B的反应速率 为0.2 mol•-1
C.x=2
D.若混合气体的密度不变,则表明该反应已达到平衡状态难度: 中等查看答案及解析
-
1mol H2(g)和1mol I2(g)置于某1L密闭容器中,在一定温度下发生反应:H2(g)+I2(g)⇌2HI(g)△H<0,达到平衡HI的体积分数w(HI)随时间变化如图(Ⅰ)所示.若改变反应条件,w(HI)的变化曲线如图(Ⅱ)所示,则改变的条件可能是( )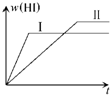
A.恒温恒容条件下,加入适当催化剂
B.恒温条件下,扩大反应容器体积
C.恒容条件下,降低温度
D.恒温条件下,再加入1molHe难度: 中等查看答案及解析
-
一定条件的密闭容器中:4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)△H=-905.9kJ•mol-1,下列叙述不正确 的是( )
A.达到平衡时放出热量为905.9 kJ,则起始时投入4 mol NH3和5 mol O2
B.平衡时4v正(O2)=5v逆(NO)
C.平衡后降压,混合气体平均摩尔质量减小
D.NH3与O2起始时物质的量之比等于4:5,则平衡后两物质的转化率一定相等难度: 中等查看答案及解析
-
燃料电池能量利用率可高达80%,下列有关燃料电池的说法错误 的是( )
A.燃料电池的负极反应物是氢气、甲烷、乙醇等物质
B.氢氧燃料电池常用于航天飞行器,产物为水经过处理之后可供宇航员使用
C.乙醇燃料电池的电解质常用KOH,负极反应为C2H5OH-12e-=2CO2↑+3H2O
D.H2SO4作电解质,甲烷燃料电池的正极反应为O2+4H++4e-=2H2O难度: 中等查看答案及解析
-
下列有关同分异构体和同系物的说法正确的是( )
A.
B.
C.式量最小且含手性C原子的烷只有一种同分异构体
D.碳原子总数小于10个的烷烃,一氯代物总数只有一种的有机物一共有4种难度: 中等查看答案及解析
-
常温下,对于醋酸溶液的下列说法中,不正确 的是( )
A.0.1 mol•L-1的醋酸溶液中加水稀释,溶液中c(OH-)减小
B.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
C.pH=4的醋酸溶液与pH=10的烧碱溶液等体积混合后溶液呈酸性
D.醋酸溶液中加入少量醋酸钾晶体,醋酸电离程度减小难度: 中等查看答案及解析
-
常温下,有下列四种溶液:①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液.下列有关说法正确的是( )
A.①、②、④溶液分别与足量铝粉反应,生成H2的量:②最少
B.四种溶液的KW相同,由水电离的c(H+):①=③>②=④
C.将①、④两种溶液混合后,若pH=7,消耗溶液的体积为:①>④
D.向等体积的四种溶液中分别加入1000 mL水后,溶液的pH:③>④>②>①难度: 中等查看答案及解析
-
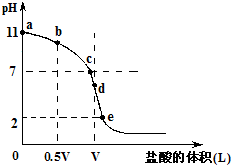
25℃时,将pH=3的HA溶液与pH=11的BOH溶液等体积混合,所得溶液pH小于7.下列说法不正确 的是( )
A.HA为弱酸
B.混合溶液中加水稀释,pH升高,溶液导电能力减弱
C.等物质的量浓度等体积的NaA与NaCl溶液,溶液中的离子数目相等
D.混合溶液中滴加氨水至溶液的pH=7,所得溶液中c(A-)=c(NH)+c(B+)难度: 中等查看答案及解析
-
已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8kJ•mol-1、1411.0kJ•mol-1和1366.8kJ•mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
A.-44.2 kJ•mol-1
B.+44.2 kJ•mol-1
C.-330 kJ•mol-1
D.+330 kJ•mol-1难度: 中等查看答案及解析
-
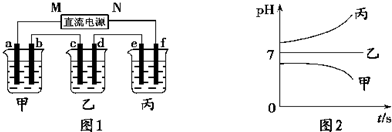
如图中a、b是惰性电极,通电2min后b电极附近溶液呈红色,b电极生成标准状况时的气体体积为0.224L,NaCl溶液体积为500mL,下列说法不正 确 的是( )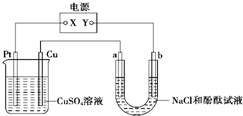
A.电解过程中CuSO4溶液物质的量浓度不变
B.电子流动的方向是由a流向Cu电极
C.电路中通过的电子为0.02mol
D.电解速率v(OH-)=0.02mol/(L.min)难度: 中等查看答案及解析
-
已知H-H键能436kJ/mol;Cl-Cl键能243kJ/mol;H-Cl键能431kJ/mol,则下列热化学方程式正确的是( )
A.H2(g)+Cl2(g)=2HCl(g)△H=-183 kJ/mol
B.H2(g)+
Cl2(g)=HCl(g)△H=-124kJ/mol
C.2HCl(g)=H2(g)+Cl2(g)△H=-248 kJ/mol
D.HCl(g)=H2(g)+
Cl2(g)△H=-91.5 kJ/mol
难度: 中等查看答案及解析
-
有①Na2CO3溶液 ②CH3COONa溶液 ③NaOH溶液 ④CH3COONH4溶液各25mL,物质的量浓度均为0.1mol•L-1,下列说法正确的是( )
A.水电离的c(OH-)最大的是③
B.四种溶液pH大小顺序③>②>①>④
C.若将四种溶液稀释相同倍数,pH变化最大的是④
D.若分别加入25 mL 0.1 mol•L-1盐酸充分反应后,pH最大的是①难度: 中等查看答案及解析
-
已知25℃时,Ka(HF)=3.6×10-4,Ksp(CaF2)=1.46×10-10.现向1L 0.2mol•L-1 HF溶液中加入1L 0.2mol•L-1 CaCl2溶液,则下列说法中,正确的是( )
A.HF与CaCl2反应产生沉淀
B.25℃时0.2mol•L-1HF溶液中pH=2
C.Ksp(CaF2)随温度和浓度的变化而变化
D.该体系中最终没有氟化氢分子难度: 中等查看答案及解析
-
如图,隔板K可左右移动,甲中充入2mol A和1mol B,乙中充入2mol C和1mol He,此时K停在0处.发生反应2A(g)+B(g)⇌2C(g),达到平衡后,恢复至温度.下列有关说法不正确 的是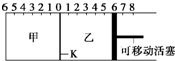
( )
A.达平衡后,隔板K最终停留在左侧刻度0~2之间
B.若平衡时K停留在左侧1处,则活塞停留在右侧6处
C.达到平衡时,甲容器中B的物质的量小于于乙容器中B的物质的量
D.根据隔板K滑动与否可判断左右两边的反应是否达到平衡难度: 中等查看答案及解析