-
下图(左)是还原铁粉与水蒸气反应的实验装置,实验时,B中灰色的铁粉变为
黑色,且生成的黑色固体物质是一种可溶于稀盐酸的较复杂化合物。请回答下列问题:

(1)B中发生反应的化学方程式为________。
(2)反应前A中投放碎瓷片的目的是________。
(3)某次实验后,取B中的固体物质少量,溶于足量稀盐酸,再滴加KSCN溶液。
溶液颜色无明显变化,试解释原因。
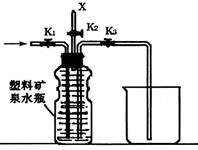
(4)上图(左)中虚线部分,可以用右图所示装置代替,在X口点燃收集到的气体即可检验H2的存在。实验开始时,打开K1.K2,关闭K3,使反应先进行一段时间之后,必须进行________ 操作,方可关闭K2.打开K3,再收集气体。当收集到半瓶气体时,停止加热,关闭K1,若要使H2顺利逸出而进行点燃实验,操作的方法是 。
(5)替代装置未像原装置那样使用干燥管,同样顺利完成了实验,原因是 。
难度: 极难查看答案及解析
-
已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
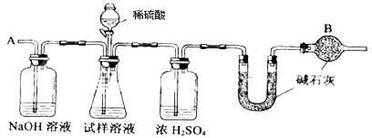
主要实验步骤如下:
①按图组装仪器,并检查装置的气密性
②将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U型管的质量,得到b g
④从分液漏斗滴入6mol·L-1的硫酸,直到不再产生气体时为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U型管的质量,得到c g
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为d g
请填空和回答问题:
(1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明________;
(2)装置中干燥管B的作用是 ;
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果________(填偏高.偏低或不变);
(4)步骤⑤的目的是 ;
(5)步骤⑦的目的是 ;
(6)该试样中纯碱的质量分数计算式为 。
难度: 极难查看答案及解析
-
在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH的物质的量(mol)和所得沉浮的物质的量(mol)的关系如下图所示。则:
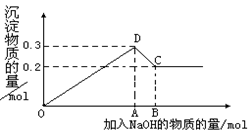
(1)写出代表各线段发生反应的离子方程式:
OD段._______,
DC段__________________________ 。
(2)原溶液中Mg2+.Al3+物质的量浓度之比为________。
(3)图中C点表示当加入________mol NaOH时,Al3+已经转化为 ,Mg2+已经转化为________。
(4)图中线段OA∶AB=。
难度: 极难查看答案及解析
-
下列中学化学中常见物质的转化关系图中,反应条件及部分反应物和产物未全部注明,已知A.D为金属单质,其他为化合物.

试推断:
(1)写出物质的化学式:A:____________.C:____________.I:____________.
(2)写出下列反应的方程式:
C→F的离子方程式______________________________________________.
H→I的化学方程式________________________________________________.
难度: 极难查看答案及解析
-
将Fe和Cu的混合粉末加入到100 mL 4 mol/L稀硝酸中充分反应后:
(1)若反应后有Cu剩余,则此溶液中一定有的阳离子是__________,可能有的阳离子是________.(不考虑水电离出的H+,下同)
(2)若反应后的溶液中有Fe3+,则溶液中一定含有的阳离子是________,可能含有的阳离子是________.
(3)如果反应后的溶液中无金属剩余,则加入金属粉末的最大质量应小于________.
(4)如果加入的Fe和Cu的质量比为7∶8,则使HNO3完全反应的金属粉末的最小质量为________.
难度: 极难查看答案及解析
-
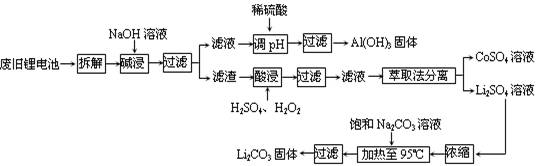 2006年世界锂离子电池总产量超过25亿只,锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的。因此锂离子电池回收具有重要意义,其中需要重点回收的是正极材料,其主要成分为钴酸锂(LiCoO2).导电乙炔黑(一种炭黑).铝箔以及有机粘接剂。某回收工艺流程如下:
2006年世界锂离子电池总产量超过25亿只,锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的。因此锂离子电池回收具有重要意义,其中需要重点回收的是正极材料,其主要成分为钴酸锂(LiCoO2).导电乙炔黑(一种炭黑).铝箔以及有机粘接剂。某回收工艺流程如下:(1)上述工艺回收到的产物有________。
(2)废旧电池可能由于放电不完全而残留有原子态的锂,为了安全对拆解环境的要求是_______________。
(3)碱浸时主要反应的离子方程式为_____________________。
(4)酸浸时反应的化学方程式为___________。如果用盐酸代替H2SO4和H2O2的混合液也能达到溶解的目的,但不利之处是_______________。
(5)生成Li2CO3的化学反应方程式为____________。已知Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应____________。
难度: 极难查看答案及解析
-
A.⑴CH3+.CH3-.CH3-都是重要的有机反应中间体,有关它们的说法正确的是________。
A.它们均由甲烷去掉一个氢原子所得
B.它们互为等电子体,碳原子均采取sp2杂化
C.CH3-与NH3.H3O+互为等电子体,几何构型均为三角锥形
D.CH3+中的碳原子采取sp2杂化,所有原子均共面
E.两个CH3-或一个CH3+和CH3-结合均可得到CH3CH3
(2)锌是一种重要的金属,锌及其化合物有着广泛的应用。
①指出锌在周期表中的位置:________周期,________族,________区。
②葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂。写出Zn2+基态电子排布式________;葡萄糖分子中碳原子杂化方式有________。
③Zn2+能与NH3形成配离子[Zn(NH3)4]2+。配位体NH3分子属于________(填“极性分子”或“非极性分子”);在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在左下图中表示[Zn(NH3)4]2+中Zn2+与N之间的化学键。
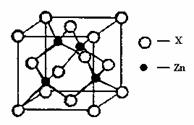
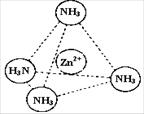
④右上图表示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为________;该化合物的晶体熔点比干冰高得多,原因是________。
难度: 极难查看答案及解析