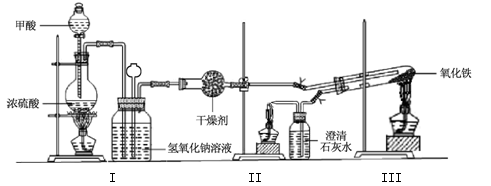
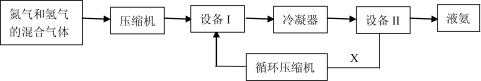
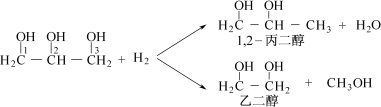
-
化学与生活息息相关,下列说法错误的是
A.乙烯可作为水果的催熟剂
B.地沟油经过处理,可用来制造肥皂
C.漂白粉长期暴露在空气中会变质失效
D.煤炭燃烧过程安装固硫装置,可有效提高煤的利用率
难度: 中等查看答案及解析
-
异戊烷的二氯代物的同分异构体有
A.6种 B.8种 C.10种 D.12种
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的值,下列说法正确的是
A.常温常压,11.2 L NO和O2混合气体的原子数为NA
B.1.5 g甲基所含有的电子数目为0.9NA
C.1 L 0.1mol/L的氨水中含有的N原子数小于0.1NA
D.7.8g苯中碳碳双键的数目为0.3NA
难度: 中等查看答案及解析
-
下列有关物质的实验操作、现象及结论描述正确的是
选项
实验操作及现象
结论
A
用铂丝蘸取某待测液在酒精灯外焰上灼烧,火焰呈紫色(透过蓝色钴玻璃)
待测试液中一定含有钾元素,可能含钠元素
B
向某无色溶液中通入过量的CO2气体,有白色沉淀产生
该溶液中一定含有SiO32–
C
向品红溶液中通入某气体后,溶液褪色
该气体一定是SO2
D
向NaOH溶液中滴加MgCl2溶液,产生白色沉淀,继续滴加FeCl3溶液产生红褐色沉淀
Fe(OH)3的溶解度大于Mg(OH)2的溶解度
难度: 中等查看答案及解析
-
常温下,下列关于电解质溶液的说法正确的是
A.将pH=4 CH3COOH溶液加水稀释10倍,溶液中各离子浓度均减小
B.用 CH3COOH溶液滴定等物质的量浓度的NaOH溶液至pH=7,V(CH
3COOH溶液)<V(NaOH溶液)
C.向0.2 mol/L的盐酸溶液中加入等体积0.1 mol·L—1 NH3·H2O溶液:c(Cl–)+c(OH–)=c(H+)+ c(NH3·H2O)
D.在含0.1mol NaHSO4溶液中:c(H+)=c(SO42–)+c(OH–)
难度: 中等查看答案及解析
-
短周期元素W、X、Y和Z的原子序数依次增大。元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍。下列说法错误的是
A.元素Z可与元素X形成共价化合物XZ2
B.元素X与氢形成的原子比为1∶1的化合物有很多种
C.元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成
D.元素W、X的氯化物中,各原子均满足8电子的稳定结构
难度: 困难查看答案及解析
-
用一种阴、阳离子双隔膜三室电解槽处理废水中的NH4+,模拟装置如图所示。下列说法正确的是

A.阳极室溶液由无色变成棕黄色
B.阴极的电极反应式为:4OH–-4e–=2H2O+O2↑
C.电解一段时间后,阴极室溶液中的pH升高
D.电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4
难度: 中等查看答案及解析