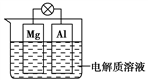
-
短周期元素X、Y、Z所在的周期数依次增大,它们的原子序数之和为20,且Y2-与Z+核外电子层的结构相同。下列化合物中同时存在极性和非极性共价键的是( )
A. Z2Y B. X2Y2 C. Z2Y2 D. ZYX
难度: 中等查看答案及解析
-
根据叙述判断下列各元素一定属于主族元素的是
A. 元素的原子最外层电子数为2 B. 元素的原子最外层电子数为6
C. 位于元素周期表中ⅡA族右边的元素 D. 阴离子RO4—中R元素
难度: 中等查看答案及解析
-
氢氧燃料电池已用于航天飞机。以30%KOH溶液为电解质溶液的这种电池在使用时的电极反应如下:2H2+4OH--4e-═4H2O,2H2O+O2+4e-═4OH-;据此作出判断,下列说法中错误的是
A.H2在负极发生氧化反应
B.供电时的总反应为:2H2+O2═2H2O
C.产物为无污染的水,属于环境友好电池
D.燃料电池的能量转化率可达100%
难度: 简单查看答案及解析
-
有甲、乙两位同学,他们一起做了水果电池的实验,测得的数据如下表:
实验序号
电极材料
水果品种
电极间距/cm
电压/mV
1
锌
铜
菠萝
3
900
2
锌
铝
菠萝
3
650
3
锌
铝
苹果
3
450
下列叙述中不正确的是( )
A. 实验1中锌为负极,电子由锌经导线流向铜
B. 实验2中铝为负极,铝失去电子,电流由锌经导线流向铝
C. 实验3中铝为负极,电极反应为Al-3e-===Al3+
D. 水果电池的电压只跟水果的品种有关
难度: 困难查看答案及解析
-
下列实验不能达到预期目的的是( )
选项
实验操作
实验目的
A
浓、稀HNO3分别与Cu反应
比较浓、稀HNO3的酸性强弱
B
MgCl2、AlCl3溶液中分别加入过量NaOH溶液
比较镁、铝的金属性强弱
C
测定等浓度的H3PO4、H2SO4两溶液的pH大小
比较磷、硫的非金属性强弱
D
用等浓度的盐酸、碳酸氢钠两溶液混合反应
比较盐酸、碳酸的酸性强弱
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
为比较铁和铜金属活动性强弱,某研究小组的同学设计了如下一些方案,并将实验结果记录如下:
方案
现象或产物
①将铁片置于CuSO4溶液中
铁片上有亮红色物质析出
②将铁丝和铜丝分别在氯气中燃烧
产物分别为FeCl3和CuCl2
③将铁片和铜片分别放入热浓硫酸中
产物分别为Fe2(SO4)3和CuSO4
④将铁片和铜片分别置于稀硫酸溶液中
铁片上有气泡,铜片上不产生气泡
⑤将铁片和铜片同时插入盛有稀硫酸的烧杯中,并用导线连接
铁片溶解,铜片上有气泡产生
能根据以上各种现象或产物证明铁的金属活动性比铜强的方案一共有( )
A. 2种 B. 3种 C. 4种 D. 5种
难度: 中等查看答案及解析
-
化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
A. N2电子式为N⋮⋮N
B. Cl-的结构示意图为
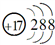
C. CO2的结构式为O—C—O
D. 质量数为37的氯原子为
Cl
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 用电子式表示氯化氢分子的形成过程:

B. 一定条件下从正反应开始的某可逆反应达到化学平衡时,正反应速率降到最小
C. 酸与碱发生中和反应时吸收热量
D. 升高温度,化学反应速率减小
难度: 中等查看答案及解析
-
下面几种情况,能够形成原电池的是( )
A.
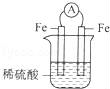 B.
B.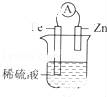
C.
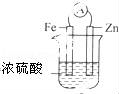 D.
D.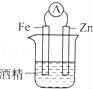
难度: 中等查看答案及解析
-
反应4A(s)+3B(g)===2C(g)+D(g),经2 min,B的浓度减少0.6 mol·L-1。下列说法正确的是( )
A.用A表示的反应速率是0.4 mol·L-1·min-1
B.分别用B、C、D表示反应的速率,其比值是3∶2∶1
C.在2 min末的反应速率,用B表示是0.3 mol·L-1·min-1
D.在这2 min内B和C两物质浓度都是逐渐减小的
难度: 中等查看答案及解析
-
对于反应Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g),下列叙述不正确的是( )
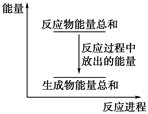
A. 其反应物或生成物都能用来表示该反应的速率
B. 反应过程中能量关系可用上图表示
C. 若将该反应设计成原电池,锌为负极
D. 若设计为原电池,当有32.5 g锌溶解,标准状况下正极放出11.2 L气体
难度: 中等查看答案及解析
-
据国外有关资料报道,在独居石(一种共生矿,化学成分为Ce、La、Nb等的磷酸盐)中,查明有尚未命名的116、124、126号元素。试判断116号元素应位于周期表的

A. 第六周期第ⅣA族 B. 第七周期第ⅥA族
C. 第七周期第ⅦA族 D. 第八周期第ⅥA族
难度: 中等查看答案及解析
-
下图表示化学反应过程中的能量变化,据图判断下列说法中合理的是( )

A.500mL 2.0mol·L-1 HCl和500mL 2.0mol·L-1 NaOH的反应符合图1,且ΔE=57.3kJ
B.500mL 2.0mol·L-1 H2SO4和500mL 2.0mol·L-1 Ba(OH)2的反应符合图2,且ΔE=114.6kJ
C.发生图1能量变化的任何反应,一定不需加热即可发生
D.CaO、浓硫酸溶于水时的能量变化符合图1
难度: 中等查看答案及解析
-
反应4NH3(g)+5O2(g)
4NO(g)+6H2O(g),在5 L密闭容器中进行,半分钟后,NO的物质的量增加了0.3 mol,则此反应的平均速率为( )
A. v(O2)=0.01 mol/(L·s) B. v(NO)=0.008 mol/(L·s)
C. v(H2O)=0.003 mol/(L·s) D. v(NH3)=0.004 mol/(L·s)
难度: 中等查看答案及解析
-
如图所示装置,电流表G发生偏转,a极逐渐变粗,同时b极逐渐变细,c为电解质溶液,则a、b、c应是下列各组中的
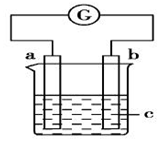
A. a是Ag、b是Fe、c为AgNO3溶液 B. a是Fe、b是Ag、c为AgNO3溶液
C. a是Zn、b是Cu、c为稀H2SO4 D. a是Cu、b是Zn、c为稀H2SO4
难度: 中等查看答案及解析
-
一定温度下在一容积不变的密闭容器中发生可逆反应2X(g)
Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是( )
A. 混合气体的密度不再变化 B. 反应容器中Y的质量分数不变
C. X的分解速率与Y的消耗速率相等 D. 单位时间内生成1 mol Y的同时生成2 mol X
难度: 中等查看答案及解析