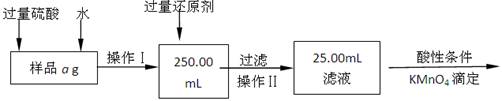
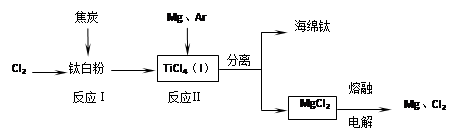-
下列有关化学与生活、工业的叙述中,不正确的是
A.工业上生产玻璃、水泥、漂白粉及用铁矿石冶炼铁,均需要用石灰石为原料
B.高空中臭氧层能够吸收太阳紫外线,为地球上的生物提供了天然的保护屏障,但低空的臭氧是污染气体,会给生物造成伤害
C.2011年5月份起,面粉中禁止添加CaO2 、过氧化苯甲酰等增白剂,CaO2属于碱性氧化物,过氧化苯甲酰属于有机物
D.地沟油由于混有一些对人体有害的杂质而不能食用,可加工制成生物柴油,生物柴油的成分与从石油中提取的柴油成分不同
难度: 简单查看答案及解析
-
我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3×10-9m、分子式为C32H16N8Co)恢复了磁性。已知该物质主要用于有机反应中的催化剂以及光电子等高新技术领域。下列说法中不正确的是
A.“钴酞菁”分子所形成的分散系具有丁达尔效应
B.该物质属于有机高分子化合物
C.此项工作的研究表明,人们可以改变分子的某些物理性质
D.此项研究结果可广泛应用于光电器件、生物技术等方面
难度: 简单查看答案及解析
-
已知0.1mol/L的醋酸溶液中存在电离平衡: CH3COOH
CH3COO-+H+ 要使溶液中c(H+)/c(CH3COOH)比值增大,可以采取的措施是
A.加少量CH3COONH4固体 B.降低温度 C.加少量NaCl固体 D.升高温度
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A.1mol NO2与足量H2O反应,转移电子数为2mol
B.1mol C5H12分子中含有的共价键数目为16NA
C.1L 0.5mol/LNa2CO3溶液中阴离子数目小于0.5mol
D.CO2通过Na2O2使其增重bg时,反应中转移的电子数为
难度: 简单查看答案及解析
-
下列实验设计和结论相符的是
A.某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性
B.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
C.某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42-
D.在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液
难度: 简单查看答案及解析
-
美国“海狼”潜艇上的核反应堆内使用了液体铝钠合金(单质钠和单质铝熔合而成)作载热介质,有关说法不正确的是
A.原子半径:r(Na)>r(Al)
B.铝钠合金若投入一定的水中可得无色溶液,则n(Al)<n(Na)
C.m g不同组成的铝钠合金投入足量盐酸中,若放出H2越多,则铝的质量分数越小
D.铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀也可能有铜析出
难度: 简单查看答案及解析
-
向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,溶液变为棕色。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色。则下列分析中正确的
A.滴加KI溶液时,转移2mol e- 时生成1mol白色沉淀
B.通入SO2后溶液逐渐变成无色,体现了SO2的漂白性
C.通入SO2时,SO2与I2反应,I2作还原剂
D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2
难度: 简单查看答案及解析
-
某溶液仅含Fe2+、Na+、Al3+、Ba2+、SO42-、NO3-、Cl-中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法不正确的是
A.若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72g
B.若向该溶液中加入过量的稀硫酸,产生的气体遇空气能变成红棕色
C.若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色
D.该溶液中所含的离子是:Fe2+、Na+、SO42-、NO3-
难度: 简单查看答案及解析
-
下列离子方程式书写不正确的是
A.NaOH溶液与SO2反应,当n(NaOH):n(SO2)=4:3时,4OH- + 3SO2 = SO32-+ 2HSO3- + H2O
B.CuCl2溶液与Na2S溶液2:1反应,Cu2++ S2--= CuS↓
C.Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时,2Fe2+ + 4Br- +3Cl2 = 2 Fe3+ + 2Br2 + 6Cl-
D. 1mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积互相均匀混合:
难度: 简单查看答案及解析
-
将一定量的氯气通入30 mL浓度为10.00 mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是
A.与NaOH反应的氯气一定为0.3 mol
B.n(Na+)∶n(Cl-) 可能为7∶3
C.若反应中转移的电子为n mol,则0.15 < n < 0.25
D.n(NaCl)∶n(NaClO)∶n(NaClO3)可能为11:2:1
难度: 简单查看答案及解析
-
25℃时,Kw =1.0×10-14;100℃时,Kw =5.5×10-13。对有关溶液pH说法正确的是
A.100℃时,pH=12的NaOH(aq)和pH=2的H2SO4(aq)恰好中和,所得溶液的pH=7
B.25℃时,pH=12的氨水和pH=2的H2SO4(aq)等体积混合,所得溶液的pH>7
C.100℃时,0.2 mol/L Ba(OH)2(aq)和0.2 mol/L HCl(aq)等体积混合,所得溶液的pH=7
D.25℃时,0.2 mol/L NaOH(aq)与0.2 mol/L CH3COOH(aq)恰好中和,所得溶液的pH=7
难度: 简单查看答案及解析
-
室温时,向10mL的醋酸稀溶液中逐滴滴入NaOH稀溶液至过量,有关叙述正确的是
A.实验过程中水的电离程度的变化是先减小后增大
B.当溶液呈中性时,反应恰好完全
C.当反应恰好完全时,消耗NaOH溶液10mL
D.当溶液呈碱性时,其中离子浓度由大到小的顺序可能为c(Na+)>c(OH-)>c(Ac-)>c(H+)
难度: 简单查看答案及解析
-
温度为T时,向2.0L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
t/s
0
50
150
250
350
n(PCl3)/ mol
0
0.16
0.19
0.20
0.20
A.反应在前50 s的平均速率为v(PCl3)=0.0032 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol·L-1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20molCl2,达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0mol PCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80%
难度: 简单查看答案及解析
-
在某些化学知识用数轴表示能体现出直观形象、简明易记的特点。下列用数轴表示正确的是
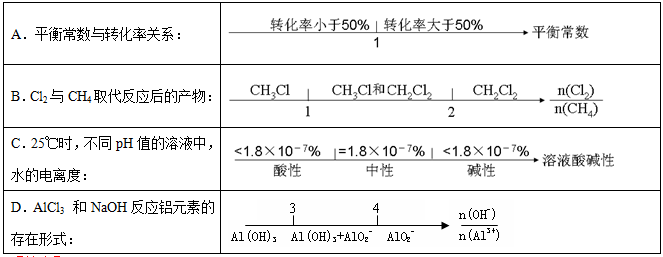
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.HF、HCl、HBr、HI的热稳定性依次减弱,沸点却依次升高
B.熔融状态下能导电的化合物一定含离子键;金属与非金属元素形成的化合物一定是离子化合物
C.NaHSO4晶体中阴、阳离子的个数是1:2且熔化时破坏的是离子键和共价键
D.NCl3分子中所有的原子均为8电子稳定结构
难度: 简单查看答案及解析
-
将pH=1的盐酸平均分成2份,1份加适量水,另1份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高了1,则加入的水与NaOH溶液的体积比为(稀溶液中体积变化忽略不计)( )
A.9 B.10 C.11 D.12
难度: 简单查看答案及解析
-
下列图示与对应的叙述相符的是
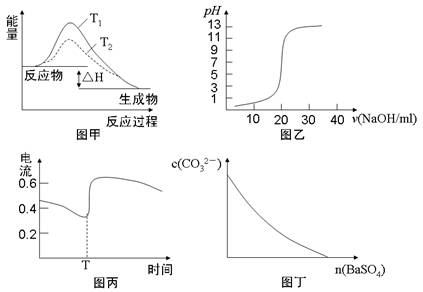
A.图甲表示T1>T2,SO2与O2反应过程中的能量变化
B.图乙表示0.1000mol·L-1 NaOH溶液滴定20.00ml 0.1000mol·L-1 CH3COOH溶液所得到的滴定曲线
C.图丙表示Zn-Cu原电池反应过程中的电流强度的变化,T时可能加入了H2O2
D.图丁表示在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO32-)的浓度变化
难度: 简单查看答案及解析
-
A、B、C分别是元素甲、乙、丙的单质,它们都是常见的金属或非金属,D、E、F是常见的三种氧化物,且有如图所示转化关系,则下列说法不正确的是
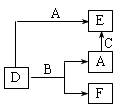
A.D、E中一定都含有A的元素
B.单质B肯定是氧化剂
C.A、B、C中一定有一种是氧元素的单质
D.若A是非金属,则B一定为金属
难度: 简单查看答案及解析
-
向足量H2SO4溶液中加入100mL 0.4 mol·L—1 Ba(OH)2溶液,放出的热量是5.12kJ。如果向足量Ba(OH)2溶液中加入100mL 0.4 mol·L—1 HCl溶液时,放出的热量为2.2kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为
A.Ba2+(aq)+SO42—(aq)=BaSO4(s) △H=-18kJ·mol—1
B.Ba2+(aq)+SO42—(aq)=BaSO4(s) △H=-2.92kJ·mol—1
C.Ba2+(aq)+SO42—(aq)=BaSO4(s) △H=-0.72kJ·mol—1
D.Ba2+(aq)+SO42—(aq)=BaSO4(s) △H=-73kJ·mol—1
难度: 简单查看答案及解析
-
现有一包铝热剂是铝粉和氧化铁粉末的混合物,在高温下使之充分反应,将反应后的固体分为两等份,进行如下实验(假定反应前后溶液的体积不变):
①向其中一份固体中加入100 mL 2.0mol•L-1的NaOH溶液,加热使其充分反应后过滤,测得溶液C(OH—)=1mol/L
②向另一份固体中加入100mL 4.0 mol•L-1的HCl溶液,使固体全部溶解,测得反应后所得溶液中只有H+、Fe2+和Al3+三种阳离子且C(H+)=0.1mol/L则产生的气体的体积(标准状况)为
A.2.352L B.2.448L C.2.688L D.2.856L
难度: 简单查看答案及解析
-
下列实验装置,试剂选用或操作正确的是( )
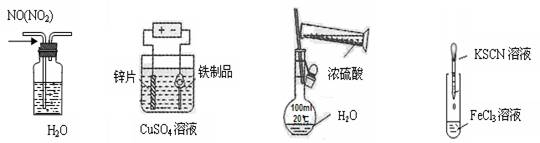
A.除去NO中NO2 B.铁制品表面镀锌 C.稀释浓硫酸 D.鉴定Fe3+
难度: 简单查看答案及解析
-
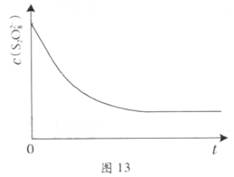
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列条件关于离子共存说法中正确的是
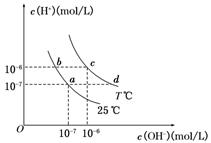
A.d点对应的溶液中大量存在:Na+、K+、SO32—、Cl—
B.b点对应的溶液中大量存在:NH4+、Ba2+、OH-、I-
C.c点对应的溶液中大量存在:Na+、Ba2+、Cl-、CO32-
D.a点对应的溶液中大量存在:Fe3+、Na+、Cl-、SO42—
难度: 简单查看答案及解析
-
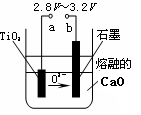
瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(下图甲)能够在煤矿巷道中的甲烷浓度达到一定浓度时,可以通过传感器显示。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如下图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动。
甲
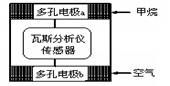 乙
乙下列有关叙述正确的的是( )
A.瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a
B.电极b是正极,O2-由电极a流向电极b
C.电极a的反应式为:CH4+5O2—―8e-=CO32- +2H2O
D.当固体电解质中有1 mol O2-通过时,电子转移4 mol
难度: 简单查看答案及解析
-
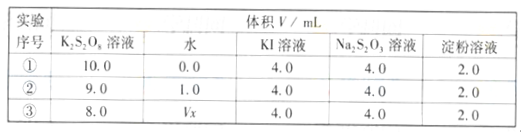
把500mLNH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含a mol氢氧化钠的溶液恰好反应完全,另取一份加入含b mol HCl的盐酸恰好反应完全产生CO2,则该混合溶液中c(Na+)为
A.
B.
C.
D.
难度: 简单查看答案及解析
-
“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用。如可利用浓NaOH溶液来“捕捉”CO2,其基本过程如下图所示(部分条件及物质未标出)。下列有关该方法的叙述中不正确的是

A.能量消耗大是该方法的一大缺点
B.“反应分离”环节中,分离物质的基本操作是蒸发结晶、过滤
C.整个过程中,有2种物质可以循环利用
D.该方法可减少碳排放,捕捉到的CO2还可用来制备甲醇等产品
难度: 简单查看答案及解析