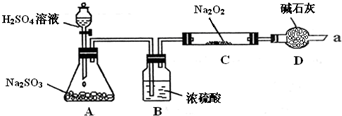
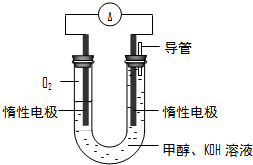
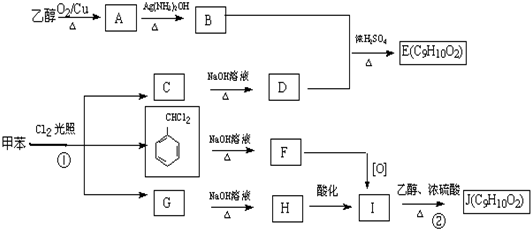
-
某合作学习小组讨论辨析下列说法正确的是( )
A.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
B.蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
C.Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到
D.天然气、石油和煤均属于可再生能源难度: 中等查看答案及解析
-
下列各组离子在碱性条件下可以大量共存,而在强酸性条件下能发生氧化还原反应的是( )
A.Ca2+、Fe2+、NO3-、Cl-
B.Ba2+、Na+、I-、NO3-
C.Na+、K+、SO42-、SO32-
D.K+、Mg2+、HCO3-、PO43-难度: 中等查看答案及解析
-
Na表示阿伏加德罗常数,下列说法中正确的是( )
A.1molFeCl3跟水完全反应转化为氢氧化铁胶体后,其中胶体粒子的数目为Na
B.由2H和18O所组成的水11g,其中所含的中子数为4Na
C.2.3g钠和足量的O2完全反应,在常温或燃烧时,转移电子数均为0.1Na
D.500mL0.1mol•L-1盐酸溶液中,含有HCl分子数目为0.05Na难度: 中等查看答案及解析
-
下列鉴别方法可行的是( )
A.用氨水鉴别Al3+、Mg2+和Ag+
B.用Ba(NO3)2溶液鉴别Cl-、SO42-和CO32-
C.用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷
D.用KMnO4酸性溶液鉴别CH3CH=CHCH2OH和CH3CH2CH2CHO难度: 中等查看答案及解析
-
3-甲基戊烷的一氯代产物有(不考虑立体异构)( )
A.3种
B.4种
C.5种
D.6种难度: 中等查看答案及解析
-
下列文字表述与对应的化学用语或名称关系正确的是( )
A.CS2的电子式为
B.光气(COCl2)结构式为
C.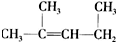 的名称为1,3-二甲基-2-丁烯
的名称为1,3-二甲基-2-丁烯
D.NaH中氢离子结构示意图为难度: 中等查看答案及解析
-
在一密闭容器中充入X和Y,在一定条件下进行如下反应:aX(g)+bY(g)
cZ(g)+dW(s),如图I是不同温度下反应达到平衡时,反应混合物中Z的体积分数和压强关系的示意图,下列说法中正确的是( )

A.由图I得K(200℃)>K(400℃),但a+b与c+d的大小无法比较
B.若a=c,在保持Y浓度不变的前提下,使X和Z的浓度增大相同的倍数,平衡正向移动
C.若反应在恒容容器中进行,达平衡后再充入气体Z,由于压强增大,平衡正向移动
D.该反应在不同温度下(T1>T2),Z的体积分数与时间的关系图象可用图Ⅱ表示难度: 中等查看答案及解析