-
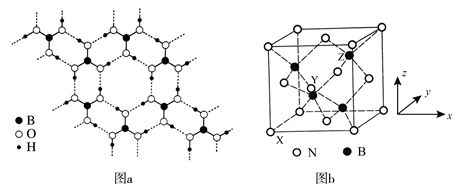
短周期元素a、b、c、d分属三个周期,且原子序数依次增大。其中b与a、c两种元素均可形成原子个数比为1:1或1:2的化合物,a、c的原子具有相同的最外层电子数,b、d形成的一种化合物在工业上是一种新型自来水消毒剂。下列说法一定正确的是
A. d的含氧酸是强酸
B. 离子半径:d>c>b
C. b、c、d形成的化合物中只含离子键
D. a、c形成的离子化合物具有还原性,可与水反应
难度: 困难查看答案及解析
-
化学离不开生活,生活也离不开化学。下列叙述中科学的是
A. 广吿语“农家肥蔬菜,无公害,绝对不含任何化学物质”
B. 医用酒精是利用了乙醇的氧化性来杀菌消毒的
C. 面食加工时加入少量小苏打粉是作膨松剂
D. 空气质量日报中计入污染指数的项目为可吸入颗粒物、SO2、NOx、CO2
难度: 中等查看答案及解析
-
工业上利用无机矿物资源生产部分材料的流程示意图如下。下列说法不正确的是
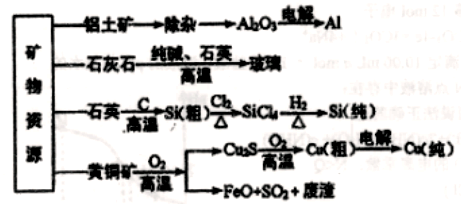
A. 在铝土矿制备较高纯度A1的过程中常用到NaOH溶液、CO2气体、冰晶石
B. 石灰石、纯碱、石英、玻璃都属于盐,都能与盐酸反应
C. 在制粗硅时,氧化剂与还原剂的物质的量之比为1∶2
D. 黄铜矿(CuFeS2)与O2反应产生的Cu2S、FeO均是还原产物
难度: 困难查看答案及解析
-
乳酸的一种合成方法:
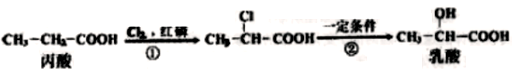
下列说法正确的是
A. 步骤①、②分别是加成反应、取代反应 B. 乳酸与丙烯完全燃烧的产物相同
C. 丙酸烃基上的二氯代物有2种 D. 蛋白质水解可生成乳酸
难度: 中等查看答案及解析
-
下列实验操作和现象与所得结论一定正确的是
选项
操作
现象
结论或解释
A
向黄色的Fe(NO)3溶液中滴加氢碘酸,再加入一定量CCl4振荡并静置
下层溶液变为紫红色
氧化性:Fe3+>I2
B
向某无色溶液中滴加稀盐酸,将产生的无色气体通入品红溶液
品红溶液褪色
原溶液中一定大量存在SO32-
C
向Mg2+和Cu2+共存的溶液中滴加适量 NaOH溶液,过滤、洗涤
得到白色沉淀
相同温度下,溶度积常数:
Ksp[Mg(OH)2]< Ksp [Cu(OH)2]
D
一定温度下,向K2Cr2O7溶液中加入少量KOH溶液
溶液橙色变浅
减小H+浓度,
Cr2O72-+H2O
2CrO42-+2H+的平衡正向移动
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
据报导,我国已研制出“可充室温钠一二氧化碳电池”,电极材料为钠金属片和碳纳米管,电解液为高氯酸钠一四甘醇二甲醚,电池总反应为:4Na+3CO2
2Na2CO3+C,生成固体Na2CO3沉积在碳纳米管上。下列叙述不正确的是
A. 放电时钠金属片发生氧化反应
B. 充电时碳纳米管接直流电源的正极
C. 放电时每消耗3molCO2,转移12mol电子
D. 充电时的阳极反应为C+2Na2CO3-4e-=3CO2↑+4Na+
难度: 简单查看答案及解析
-
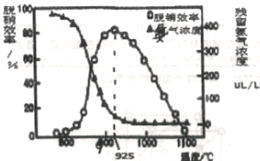
25℃时,用0.10 mol • L-1的氨水滴定10.00 mL a mol • L-1的盐酸,溶液的pH与氨水的体积(V)的关系如图所示。已知:N点溶液中存在:c(H+)=c(OH-)+c(NH3·H2O),下列说法正确的是
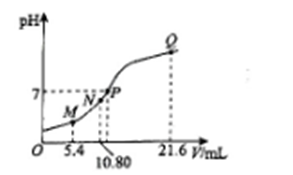
A. M点溶液中存在:c(H+)=c(OH-)+2c(NH3·H2O)+ c(NH4+)
B. N、Q两点溶液中NH3 • H2O的电离常数:N<Q
C. P 点氨水过量,c(NH4+)> c(Cl-)
D. a=0.054
难度: 困难查看答案及解析