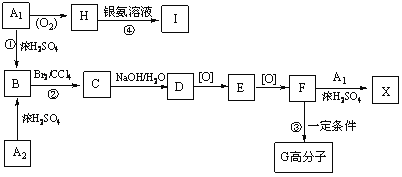
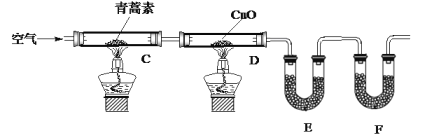
-
化学与科学、技术、社会、环境密切相关。下列有关说法正确的是
A. “绿色化学”的核心是应用化学原理对环境污染进行治理
B. “火树银花”中的焰火实质上是金属元素的焰色反应
C. 李白有诗云“日照香炉生紫烟”,这是描写“碘的升华”
D. 煤经过气化、液化和干馏等物理变化过程,可以转化为清洁能源
难度: 中等查看答案及解析
-
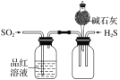
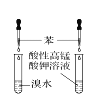
下列有关实验装置及实验方案的设计不正确的是
选项
A
B
C
D
实验装置

实验设计
探究SO2的氧化性和漂白性
实验室制氨气并收集干燥的氨气
验证苯中是否有碳碳双键
用乙醇提取溴水中的Br2
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列有关有机物的叙述不正确的是
A. 分子式为C5H10O2且能与Na2CO3溶液反应产生气体的有机物的同分异构体有4种
B. 用酸性高锰酸钾溶液既可以鉴别甲烷和乙烯,也可以除去甲烷中的乙烯
C. 乙烷和氯气制氯乙烷和乙烯与氯化氢反应制氯乙烷反应类型不同
D. 用碳酸钠溶液可一次性鉴别乙酸、苯和乙醇三种无色液体
难度: 中等查看答案及解析
-
科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。质子膜H2S燃料电池的结构示意图如下图所示。下列说法不正确的是
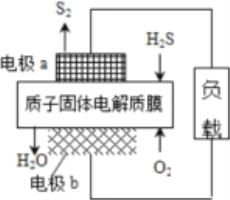
A. 电极a为电池的负极
B. 电极b上发生的电极反应为:O2 +4H+ + 4e﹣=== 2H2O
C. 电路中每流过4 mol电子,在正极消耗44.8 LH2S
D. 每17 g H2S参与反应,有1 mol H+经质子膜进入正极区
难度: 中等查看答案及解析
-
已知A、B、C、D为短周期元素构成的四种物质,它们有如下转化关系,且D为强电解质(其它相关物质可能省略)下列说法不正确的是( )

A. 若A为非金属单质,则D一定为硝酸或硫酸
B. 若A为金属单质,则组成A的元素一定位于第三周期第IA族
C. 不论A为单质还是化合物,D都有可能是同一种物质,该物质的浓溶液在常温下能使铁和铝发生钝化
D. 若A是共价化含物,A的水溶液一定显碱性
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值,下列说法不正确的是
A. 9 g
中含有的电子数为3.6 NA
B. 某温度下纯水的pH=6,该温度下1L pH=11的NaOH溶液中含OH-的数目为0.1NA
C. 一定温度下,1 L 0.5 mol·L-1 NH4Cl溶液与2 L 0.25 mol·L-1NH4Cl溶液含
均为0.5NA
D. 丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA
难度: 困难查看答案及解析
-
常温下,向100 mL 0.01 mol•L﹣1 HA溶液中逐滴加入0.02 mol•L﹣1的MOH溶液,图中所示曲线表示混合溶液的pH变化情况,下列说法不正确的是
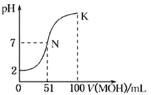
A. HA为一元强酸,MOH为一元弱碱
B. N点溶液中离子浓度大小关系为:c(M+)=c(A﹣)>c(H+)=c(OH﹣)
C. N点水的电离程度大于K点水的电离程度
D. N→K之间曲线上任意一点都有c(M+) >c(OH﹣)>c(A﹣)>c(H+)
难度: 困难查看答案及解析