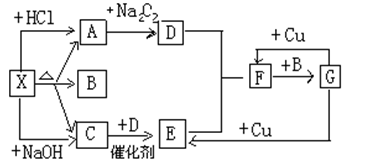
-
在“十二五”期间,江苏省将大力实施“清水蓝天”工程。下列不利于“清水蓝天”工程实施的是
A.积极推广太阳能、风能、地热能及水能等的使用,减少化石燃料的使用
B.加强城市生活污水脱氮除磷处理,遏制水体富营养化
C.加大稀土资源的开采和出口,保证经济快速发展
D.大力实施矿物燃料“脱硫、脱硝技术”,减少硫的氧化物和氮的氧化物污染
难度: 中等查看答案及解析
-
下列说法中正确的是
A.SO2和SO3互为同分异构体 B.二氧化碳和干冰互为同素异形体
C.金刚石和石墨互为同位素 D.C2H5OH和CH3OCH3互为同分异构体
难度: 中等查看答案及解析
-
有关化学用语正确的
A.次氯酸的电子式:H ∶Cl∶O∶ B.二氧化硅的分子式:SiO2
C.氮气的结构式:∶N≡N∶ D.氯化镁的电子式:
难度: 中等查看答案及解析
-
对于下列事实的解释错误的是
A.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C.常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应
D.氨水可使酚酞试剂变为红色,说明氨溶解于水显弱碱性
难度: 中等查看答案及解析
-
限用一种试剂, 经过一次性实验就能鉴别下列四种溶液:Na2CO3、(NH4)2SO4、NH4Cl、KNO3, 应选用:
A.AgNO3溶液 B.NaOH溶液
C.Ba(OH)2溶液 D.盐酸
难度: 中等查看答案及解析
-
用稀硫酸与铁片反应制取氢气时,下列措施不能使氢气生成速率增大的是
A.给反应体系适当加热 B.向反应体系中加水稀释
C.向反应体系中加入少量氧化铜固体 D.将铁片换成铁粉
难度: 中等查看答案及解析
-
在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是
A.Na+、K+、Cl- HCO3-、 B.Na+、Cu2+ 、SO42-、NO3-
C.Mg2+、NH4+、SO42-、Cl- D.Ba2+、Fe2+、NO3-、K+
难度: 中等查看答案及解析
-
对于反应中的能量变化,表述正确的是
A.放热反应中,反应物的总能量大于生成物的总能量
B.断开化学键的过程会放出能量
C.加热才能发生的反应一定是吸热反应
D.氧化反应均为吸热反应
难度: 中等查看答案及解析
-
对于在密闭容器中、一定条件下进行的可逆反应N2(g)+3H2(g) 2NH3(g),能说明反应已达到平衡状态的是:
A.各物质体积分数相等 B.c(NH3)保持不变
C.各物质浓度相等 D.c(NH3)∶c(N2)∶c(H2)=2∶1∶3
难度: 中等查看答案及解析
-
如图所示,在用锌片、铜片和稀硫酸组成的原电池装置中,下列说法正确的是
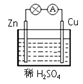
A.铜电极上的反应为Cu-2e-==Cu2+
B.放电时溶液中的阳离子向锌片移动
C.电池工作一段时间后溶液的pH值减小
D.该电池的负极材料是锌片
难度: 中等查看答案及解析
-
下列除杂质方法(括号内为杂质)中,所用试剂或操作不正确的是
A.固体Na2CO3(NaHCO3):加热
B.NO(NO2):通入装水的洗气瓶
C.NH3(H2O):通过盛有浓硫酸的洗气瓶
D.Fe2O3(Al2O3):加入氢氧化钠溶液后再过滤
难度: 中等查看答案及解析
-
燃料电池的突出优点是把化学能直接转变为电能,而不经过热能中间形式,现已广泛使用。如甲烷燃料电池,其电极反应为:负极:CH4+10OH- -8e- = CO32-+7H2O
正极:2O2+8e-+4H2O = 8OH-。今欲得27g水,则电池中电子转移的物质的量为
A.1mol B.2mol C.4mol D.6mol
难度: 中等查看答案及解析
-
下列物质中含有共价键的离子化合物是
A.H2 B.Na2O2 C.NaOH D.H2S
难度: 中等查看答案及解析
-
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图。下列有关氢氧燃料电池的说法正确的是
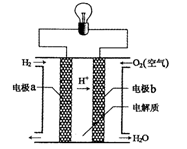
A.该电池工作时电能转化为化学能
B.该电池中电极a是正极
C.外电路中电子由电极b通过导线流向电极a
D.该电池的总反应:
难度: 中等查看答案及解析
-
在一条件下,反应N2+3H2
2NH3在10L密闭容器中进行,测得2min内,N2的物质的量由20mol减少到8mol,则2min内N2的化学反应速率为
A.1.2mol/(L·min) B.1.0 mol/(L·min)
C.0.6 mol/(L·min) D.0.4 mol/(L·min)
难度: 中等查看答案及解析
-
温度为500℃时,反应4NH3+5O2
4NO+6H2O在5L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率
(x)为
A、
(O2)=0.025 mol·L-1·s-1 B、
(NO)=0.06 mol·L-1·s-1
C、
(NH3)=0.002 mol·L-1·s-1 D、
(H2O)=0.03 mol·L-1·s-
难度: 中等查看答案及解析
-
X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是
A.X的气态氢化物比Y的稳定
B.W的最高价氧化物对应水化物的酸性比Z的强
C.Z的非金属性比Y的强
D.X与Y形成的化合物都易溶于水
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列叙述中正确的是
A、常温常压下,48gO3含有的氧原子数为3NA
B、1.8g的NH4+ 离子中含有的电子数为0.1NA
C、常温常压下,11.2 L氧气所含的原子数为NA
D、2.4g金属镁变为镁离子时失去的电子数为0.1NA
难度: 中等查看答案及解析
-
下图所示的实验操作,不能达到相应目的的是

难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.铝粉投入氢氧化钠溶液中:2Al+2OH- 2AlO2- +H2↑
B.氯化铝溶液中加入足量的氨水:Al3++3NH3·H2O Al(OH)3 ↓+3NH4+
C.氯化铁溶液中加入铁粉:Fe3+ +Fe 2Fe2+
D.碳酸钙与盐酸反应: CO
+2H+ CO2↑+ H2O
难度: 中等查看答案及解析