-

难度: 简单查看答案及解析
-
下列有关物质的分类正确的是( )
A.氯化钡、四氯化碳、硫酸、碘酒都属于化合物
B.硝酸、纯碱、磷酸钠、二氧化碳分别属于酸、碱、盐、氧化物
C.溶液、浊液、胶体、空气都属于混合物
D.CO2、SO2、P2O5、CO都属于酸性氧化物
难度: 中等查看答案及解析
-
下列基本反应类型中,一定是氧化还原反应的是( )
A.复分解反应 B.置换反应 C.分解反应 D.化合反应
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A.常温常压下,48 g O3中的氧原子数为3NA
B.24 g金属镁变为镁离子时失去的电子数为NA
C.4℃时9 mL水和标准状况下11.2 L氮气中的原子数均为NA
D.2 mol.L-l的CuCl2溶液中含有的氯离子数为4NA
难度: 困难查看答案及解析
-

A. ①③⑥ B. ②④⑥ C. ②③⑤ D. ②③⑥
难度: 中等查看答案及解析
-
下列离子检验的方法正确的是( )
A.某溶液中滴加AgNO3溶液有白色沉淀,说明原溶液中一定含有Cl-
B.某溶液先加足量盐酸无现象,再滴加BaCl2溶液有白色沉淀,则原溶液中一定含有SO42-
C.某无色溶液滴人酚酞显红色,该溶液中一定含有大量的H+
D.某溶液中滴加稀硫酸生成无色气体,说明原溶液中一定含有CO32-
难度: 中等查看答案及解析
-
下列有关氧化还原反应的叙述正确的是( )
A.氧化剂被还原,还原剂被氧化
B.有单质参加或生成的反应一定属于氧化还原反应
C.失电子难的物质,获得电子的能力一定强
D.一种元素被氧化,肯定有另一种元素被还原
难度: 中等查看答案及解析
-
下列离子方程式改写成化学方程式正确的是( )
A.Cu+2Ag+=Cu2++2Ag;Cu+2AgCl=CuCl2+2Ag
B.CO32-+2H+=CO2↑+H2O;BaCO3+2HCl=BaCl2+CO2↑+H2O
C.Al3++3OH-=Al(OH)3↓;Al(NO3)3+3NH3•H2O=Al(OH)3↓+3NH4NO3
D.H++OH-=H2O;Ba(OH)2+2HNO3=Ba(NO3)2+2H2O
难度: 中等查看答案及解析
-
在某无色透明的强碱性溶液中,能大量共存的离子组是( )
A.Na+、K+、SO42-、.HCO3- B.Cu2+、K+、SO42- 、NO3-
C.Na+、K+、SO42-、Cl- D.NH4+、K+、Cl-、NO3-
难度: 中等查看答案及解析
-
等质量的①CH4、②H2、③HC1、④SO2四种气体,在标准状况下体积由大到小的顺序是
A.②>①>③>④ B.④>③>①>② C.③>②>④>① D.①>④>②>③
难度: 中等查看答案及解析
-
ClO2是一种新型自来水消毒剂,实验室可通过以下反应制得ClO2:
2 KC1O3+H2C2O4+H2SO4
2 ClO2↑+K2SO4+2CO2↑+2H2O
下列说法正确的是( )
A.KClO3在反应中失电子
B.ClO2是氧化产物
C.H2C2O4在反应中被氧化
D.每消耗1 mol KClO3,转移电子的物质的量为2 mol
难度: 中等查看答案及解析
-
某10% NaOH溶液,加热蒸发掉100 g水后得到80 mL 20%的溶液,则该20% NaOH溶液的物质的量浓度为( )
A.5.25 mol·L-l B.12.5 mol·L-l C.7.5 mol·L-l D.6.25 mol·L-l
难度: 中等查看答案及解析
-
G、Q、X、Y、Z均为氯的含氧化合物,我们不了解它们的化学式,但知道它们在一定条件下具有如下的转化关系(未配平):
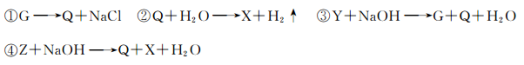
则G、Q、X、Y、Z这五种化合物中氯元素的化合价由低到高的顺序为( )
A.QGZYX B.GYQZX C.GYZQX D.ZXGYQ
难度: 中等查看答案及解析
-
某温度下将Cl。通人KOH溶液里,反应后得到KC1、KC1O、KC1O3的混合溶液,经测定ClO-与ClO3-的物质的量浓度之比为3:1,则Cl2与KOH反应时,被还原的氯元素和被氧化的氯元素的质量之比为( )
A.1 : 3 B.4 : 3 C.2 : 1 D.3 : 1
难度: 困难查看答案及解析

