-
能源的开发和利用一直是发展中的重要问题。下列说法不正确的是
A. CO2、甲烷都属于温室气体 B. 能量在转化和转移过程中其总量会不断减少
C. 太阳能、风能和生物质能属于新能源 D. 太阳能电池可将太阳能直接转化为电能
难度: 简单查看答案及解析
-
下列有关工业生产的叙述中,正确的是
A. 硫酸生产中常采用催化剂提高SO2的转化率
B. 合成氨中采用及时分离氨气提高反应速率
C. 电镀铜时,溶液中c(Cu2+)基本保持不变
D. 用电解熔融氧化镁的方法制取镁
难度: 中等查看答案及解析
-
下列利用相关数据作出的推理或判断一定正确的是
A. 利用焓变数据判断反应能否自发进行 B. 利用溶液的pH判断该溶液的酸碱性
C. 利用平衡常数判断反应进行的程度大小 D. 利用反应热数据判断反应速率的大小
难度: 中等查看答案及解析
-
关于下列各装置图的叙述中,正确的是

A. 实验室用装置①制取氨气
B. 装置②中X若为四氯化碳,可用于吸收氨气,并能防止倒吸
C. 装置③可用于制备氢氧化亚铁并观察其颜色
D. 装置④是电解池,锌电极为正极,发生氧化反应
难度: 中等查看答案及解析
-
已知:C(s)+H2O(g)=CO(g)+H2(g) △H=a kJ/mol
C(s)+O2(g)=2CO(g) △H=-220 kJ/mol
H-H、O=O和O-H键的键能分别为436、496和462 kJ/mol,则a为
A. -332 B. -118 C. +350 D. +130
难度: 困难查看答案及解析
-
反应2NO(g)+2H2(g)
N2(g)+2H2O(g)中,每生成7gN2放出166kJ的热量,该反应的速率表达式为v=k·cm(NO)·cn(H2)(k、m、n待测),其反应包含下列两步:①2NO+H2=N2+H2O2(慢)②H2O2+H2=2H2O(快),T℃时测得有关实验数据如下:
序号
c(NO)/mol•L-1
c(H2)/mol•L-1
速率/mol•L-1•min-1
Ⅰ
0.0060
0.0010
1.8×10-4
Ⅱ
0.0060
0.0020
3.6×10-4
Ⅲ
0.0010
0.0060
3.0×10-5
Ⅳ
0.0020
0.0060
1.2×10-4
下列说法错误的是
A. 整个反应速度由第①步反应决定
B. 该反应速率表达式:v=5000c2(NO)·c(H2)
C. 正反应的活化能:①<②
D. 该反应的热化学方程式为2NO(g)+2H2(g)═N2(g)+2H2O(g) △H=-664kJ•mol-1
难度: 中等查看答案及解析
-
将1 mL 0.1 mol·L-1的H2SO4溶液加入纯水中制成200 mL溶液,该溶液中由水自身电离产生的c(H+)最接近于( )
A. 1×10-3mol·L-1 B. 1×10-11mol·L-1
C. 1×10-7mol·L-1 D. 1×10-13mol·L-1
难度: 简单查看答案及解析
-
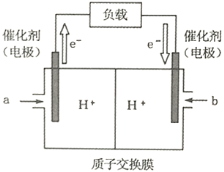
生物燃料电池(BFC)是一种真正意义上的绿色电池,其工作原理如图所示。下列说法中不正确的是

A. C2极为电池正极
B. C1极的电极反应式为:C2H5OH+3H2O-12e-=2CO2+12H+
C. 电子由C2极经外电路导线流向C1极
D. 稀硫酸中的H+向C2极移动
难度: 中等查看答案及解析
-
25℃时,在10mL浓度均为0.1mol/LNaOH和NH3·H2O混合溶液中,滴加0.1mol/L的盐酸,下列有关溶液中粒子浓度关系正确的是
A. 未加盐酸时:c(OH-)>c(Na+)= c(NH3·H2O)
B. 加入10mL盐酸时:c(NH4+) +c(H+) = c(OH-)
C. 加入盐酸至溶液pH=7时:c(Cl-) = c(Na+)
D. 加入20mL盐酸时:c(Cl-) =c(NH4+) +c(Na+)
难度: 中等查看答案及解析
-
从植物花中可提取一种简写为HIn的有机物,在水溶液中因存在以下电离平衡,故可用作酸碱指示剂。HIn(aq,红色)
H++In-(aq,黄色),在浓度为0.02 mol·L-1的下列各溶液(1)HCl、(2)Na2O2、 (3)NaCl(aq)、(4)NaHSO4(aq)、(5)NaHCO3(aq)、(6)氨水中,加入该指示剂,其中能使指示剂显黄色的是
A. (1)(4)(5) B. (2)(6) C. (1)(3)(4) D. (5)(6)
难度: 中等查看答案及解析
-
下列有关电解质溶液的说法正确的是( )
A. 向0.1mol/LCH3COOH溶液中加入少量水,溶液中
减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中
增大
C. 向盐酸中加入氨水至中性,溶液中
>1
D. 向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中
不变
难度: 中等查看答案及解析
-
有可逆反应Fe(s)+CO2(g)
FeO(s)+CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2。则下列说法不正确的是
A. 该反应的平衡常数表达式为K=c(CO)/c(CO2)
B. 该反应的逆反应是放热反应
C. v正(CO2)=v逆(CO)时该反应达到平衡状态
D. c(CO2):c(CO)=1:1时该反应达到平衡状态
难度: 中等查看答案及解析
-
某温度T1时,向容积为2L的恒容密闭容器中充入一定量的H2和I2(g),发生反应:H2(g)+I2(g)
2HI(g),反应过程中测定的部分数据见下表(表中t2>t1)。下列说法正确的是
反应时间/min
n(H2)/mol
n(I2)/mol
0
0.9
0.3
t1
0.8
t2
0.2
A. 反应在tmin内的平均速率为:v(H2)=
mol-1·L-1·min-l
B. 保持其他条件不变,向平衡体系中再通0.20molH2,与原平衡相比,达到新平衡时I2(g)转化率增大,H2的体积分数不变
C. 保持其他条件不变,起始时向容器中充入的H2和I2(g)都为0.5mol,达到平衡时 n(HI)=0.2mol
D. 升高温度至T2时,上述反应平衡常数为0.18,则正反应为吸热反应
难度: 中等查看答案及解析
-
下列实验操作对应的实验现象及解释或结论都正确的是( )
选项
实验操作
实验现象
解释或结论
A
向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液
溶液变为黄色
氧化性:H2O2>Fe3+
B
向5mL1mol/L NaOH溶液中滴加5滴1mol/L MgCl2溶液,然后再滴加足量的1mol/L CuCl2溶液
先产生白色沉淀,然后产生蓝色沉淀
Ksp[Cu(OH)2]
>Ksp[Mg(OH)2]
C
将充满NO2的密闭玻璃球浸泡在热水中
红棕色变深
2NO2(g)
N2O4(g) ΔH<0
D
向一定量酸性KMnO4溶液中加入乙二醇(HOCH2CH2OH)
溶液紫色褪去
乙二醇被氧化为乙二酸
A. A B. B C. C D. D
难度: 困难查看答案及解析
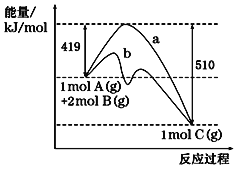

 。参照上述合成路线,设计一条由苯和乙酸为起始原料制备
。参照上述合成路线,设计一条由苯和乙酸为起始原料制备