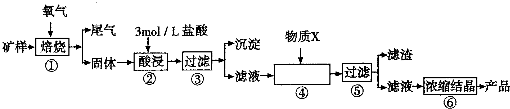
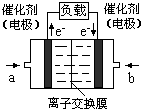
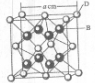
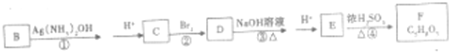
-
某烷烃的各种同分异构体中,主链上有4个碳原子的只有两种结构,则含有相同碳原子数且主链上也有4个碳原子的烯烃(只含一个碳碳双键)的同分异构体有( )
A.2种
B.3种
C.4种
D.5种难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数,下列叙述中不正确的是( )
A.通常状况下,1molSO3含有的分子数为NA个
B.1molOH-参与电解,提供的电子数目为NA个
C.标准状况下,含NA个氩原子的氩气体积约为22.4L
D.标准状况下,VL水含有的氧原子个数约为NA
难度: 中等查看答案及解析
-
下列关于有机物的说法正确的是( )
A.乙烯和苯都能使溴水褪色,褪色的原因相同
B.淀粉、蛋白质完全水解的产物互为同分异构体
C.石油裂解和油脂皂化都有高分子生成小分子的过程
D.乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去难度: 中等查看答案及解析
-
下列各溶液中能大量共存的离子组是( )
A.c(H+)=10-14mol/L的溶液中:Na+、A1O2-、S2-、SO32-
B.使pH试纸呈红色的溶液中:Fe2+、I-、NO3-、Cl-
C.碳酸氢钠溶液中:K+、SO42-、Cl-、H+
D.使酚酞试液呈红色的溶液中:Mg2+、Cu2+、SO42-、K+难度: 中等查看答案及解析
-
分析如下残缺的反应:RO3-+11+6H+=3R2↑+3H2O.下列叙述正确的是( )
A.R一定是周期表中的第VA族元素
B.R的原子半径在同周期元素原子中最小
C.上式中缺项所填物质在反应中作氧化剂
D.RO3-中的R元素在所有的反应中只能被还原难度: 中等查看答案及解析
-
已知25℃时,AgI饱和溶液中c(Ag+)为1.23×10-8mol/L,AgCl的饱和溶液中c(Ag+)为1.25×10-5mol/L.若在5mL含有KCl和KI各为0.01mol/L的溶液中,加入8mL 0.01mol/L AgNO3溶液,下列叙述正确是( )
A.混合溶液中约为1.02×103
B.加入AgNO3溶液时首先生成AgCl沉淀
C.混合溶液中c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-)
D.混合溶液中c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-)难度: 中等查看答案及解析
-
现有甲、乙两种氧化物,所含R元素的质量分数分别为0.50和0.40.若已知甲是三原子分子,则乙的化学式是( )
A.RO2
B.RO3
C.R2O3
D.R2O5难度: 中等查看答案及解析