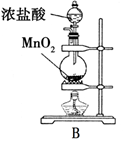
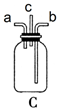
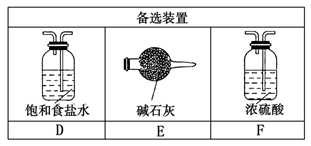
-
W、M、N、X、Y、Z是五种常见的短周期元素,其原子半径随原子序数变化如右图所示。已知W的一种核素的质量数为18,中子数为10;M和Ne原子的核外电子数相差1;N与X相邻;X的单质是一种常见的半导体材料;Y的最外层电子数是其最内层电子数的3倍;Z的非金属性在同周期主族元素中最大。

(1)元素X在周期表中的位置是_______________;元素Y的离子结构示意图为____________
(2)下列有关物质性质的比较中.正确的是________________
A.M、X、Z形成的单质熔沸点 M>X>Z
B.氢化物的热稳定性:W>X
C.X分别与W和Z形成的化合物中化学键类型,晶体类型均相同
D.Z元素含氧酸的酸性一定强于Y元素的含氧酸
(3)元素W与M按原子个数比1:1形成的化合物A的电子式为______________。
(4)X、Z与氢三种元素按1:2:2形成的五原子化合物属于_______分子(填 “极性” “非极性”)
(5)与Z同族的元素都能形成氢化物,其中水溶性最强的是______(填化学式)
(6)含有N元素的两种常见离子能发生双水解反应,试写出该离子方程式 ________________。
难度: 困难查看答案及解析
-
二甲醚是一种重要的清洁燃料,可替代氟利昂作制冷剂,对臭氧层无破坏作用。工业上可利用水煤气合成二甲醚,其反应为:3H2(g)+3CO(g)
CH3OCH3(g)+CO2(g) ΔH<0
(1)在一定条件下的密闭容器中,该反应达到平衡后,只改变一个条件能同时提高反应速率和CO的转化率的是________(填字母代号,下同)。
a.降低温度 b.加入催化剂
c.缩小容器体积 d.减少CO2的浓度
(2)若反应在体积恒定的密闭容器中进行,下列能判断反应已达平衡状态的是________
a.3V正(CO2)=V逆(CO) b.生成a mol CO2的同时消耗3a mol H2
c.气体的密度不再改变 d.混合气体的平均相对分子质量不变
(3)300℃时,在体积为2L的容器中充入4 mol H2、6 mol CO。5min时,反应恰好达平衡,此时H2的转化率为75%。
① 5min时V(CO)=_________mol/(L·min)。该温度下,此反应的平衡常数为:_______
② 保持温度不变,在以上已达反应平衡的容器中,将每种物质同时增加1mol,则此时平衡将_______移动(填“正向”、“逆向”、“不”)
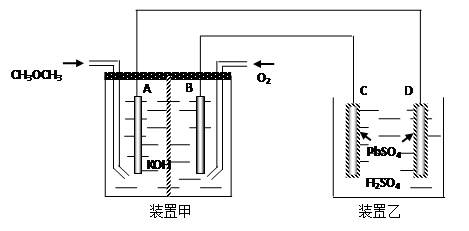
(4).下图中,甲装置为CH3OCH3、O2、KOH三者构成的燃烧电池,其电极均为Pt电极。装置乙中,C、D电极为Pb电极,其表面均覆盖着PbSO4,其电解液为稀H2SO4溶液。
① 写出甲装置中A极的电极反应式___________________________________________
② 写出乙装置中C极的电极反应式___________________________________________
③ 当有23克甲醚参加反应时,D电极的质量变化为______克。
难度: 极难查看答案及解析
-
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于工业生产的漂白及消毒。
下图是过氧化氢法生产亚氯酸钠的工艺流程图:
相关物质的性质如下:
① ClO2沸点低易气化;浓度较高的ClO2气体易分解爆炸。
② NaClO2溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O。
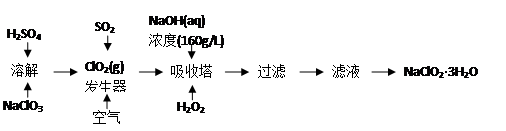
(1).在ClO2发生器中通入SO2的同时鼓入空气,其作用是________(填序号)。
A.将SO2氧化成SO3,增强酸性
B.稀释ClO2以防止爆炸
C.将NaClO3氧化成ClO2
(2)为确保H2O2充分参与反应,吸收塔内温度不宜较高,其原因是______________。
(3)160 g·L-1 NaOH溶液的物质的量浓度为______________,在实验室若要配制450mL该物质的量浓度NaOH溶液,应称取NaOH的质量为__________克。
(4)写出吸收塔内反应的化学方程式_____________________________________。
(5)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是____________(填序号)。
A.蒸馏 B.蒸发 C.灼烧 D.过滤 E.冷却结晶
要得到更纯的NaClO2·3H2O晶体必须进一步的操作是________(填操作名称)。
难度: 极难查看答案及解析