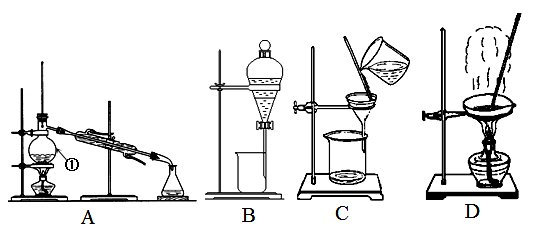
-
2011年3月11日日本发生了特大地震,福岛一核电站发生爆炸,释放出大量放射性物质,下列图标警示的是放射性物品的是

难度: 简单查看答案及解析
-
下列图示实验操作中,正确的是
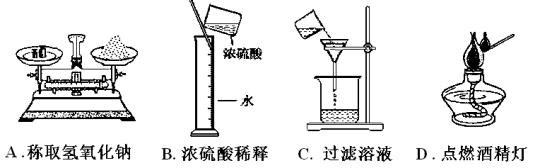
难度: 简单查看答案及解析
-
下列叙述完全正确的一组是
①气体摩尔体积约为22.4 L·mol-1
②标准状况下,22.4 L水中所含分子数为NA
③100 mL 0.1 mol·L-1的H2SO3溶液中,含有的离子数约为0.03NA
④常温常压下,1 6 gO3所含的原子数为NA
⑤9 g D2O中含有的电子数为5NA
⑥氦气的摩尔质
量为8 g
A.①③④⑤ B.④⑤⑦ C.④ D.①④
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数,下列叙述正确的是
A.常温常压下64 g SO2含有氧原子数为1NA
B.物质的量浓度为0.5 mol∙L-1的MgCl2溶液,含有Cl-数为1NA
C.标准状况下,11.2LSO3含有的原子数目为2NA
D.任何条件下,05mol N2含有分子数一定是0.5 NA
难度: 中等查看答案及解析
-
在相同的温度和压强下,CO和N2的体积相同,则下列它们的( )一定相同。
(1)分子数 (2)原子数 (3)密度 (4)质量 (5)物质的量
A.只有(1)(5) B.只有(1)(2)(4)(5)
C.只有(2)(3)(4)(5) D.(1)(2)(3)(4)(5)
难度: 中等查看答案及解析
-
下列溶液中的氯离子数目、浓度与50 mL 1 mol·L- 1的FeCl3溶液中氯离子数目、浓度相等的是
A.50 mL 1.5 mol·L-1的CaCl2溶液
B.100 mL 3 mol·L-1的NH4Cl溶液
C.75 mL 3 mol·L-1的KCl溶液
D.50 mL 2 mol·L-1的FeCl2溶液
难度: 简单查看答案及解析
-
实验室中需要0.2mol/L的NaOH溶液65mL,配制该溶液时应选用的容量瓶的规格和称取的NaOH质量分别是
A.65mL,0.52g B.70ml,0.56g
C.100mL,0.52g D.100mL,0.8g
难度: 中等查看答案及解析
-
按照物质的树状分类和交叉分类,HNO3属于
①酸 ②氢化物 ③氧化物 ④含氧酸 ⑤难挥发性酸 ⑥一元酸 ⑦化合物 ⑧混合物
A.①②③④⑤⑥⑦ B.①④⑥⑦ C.①⑧ D.①④⑤⑥
难度: 中等查看答案及解析
-
下列应用或事实与胶体的性质没有关系的是
A.工厂利用高压电除尘,有利于减轻雾霾和预防大气污染
B.在饱和氯化铁溶液中逐滴加入NaOH溶液,产生红褐色沉淀
C.过滤泥水混合物,用激光笔照射滤液,能产生光亮的通路
D.江河入海出容易形成三角洲,如长江三角洲和黄河三角洲的形成
难度: 简单查看答案及解析
-
下列说法正确的是
A.强电解质溶液的导电性一定比弱电解质强
B.医疗上血液的透析利用了胶体的性质,而用FeCl3紧急止血与胶体的性质无关
C.浓盐酸具有很强的导电性,浓盐酸是电解质
D.胶体与溶液的本质区别是分散质微粒的大小,可利用丁达尔现象区别溶液与胶体
难度: 简单查看答案及解析
-
下列说法正确的是
A.氯化银、碳酸钙、硫酸钡难溶于水,所以他们不是电解质
B.SO3、CO2水溶液均能导电,所以SO3、CO2均是电解质
C.蔗糖、酒精在水溶液中和熔化时不导电,所以它们是非电解质
D.铜、石墨均能导电,所以它们是电解质
难度: 中等查看答案及解析
-
下列各电离方程式中,错误的是
A.NaOH = Na++ O2- +H+ B.Na2SO4=2Na++SO42-
C.HNO3 = H++NO3- D.MgCl2=Mg2 ++2Cl-
难度: 简单查看答案及解析
-
常温下,下列各组微粒在指定溶液中一定能大量共存的是
A.纯碱溶液:K+、SO42-、OH-、Cl-
B.使酚酞变红的溶液:K+、H+、SO42-、CO32-
C.澄清石灰水:Na+、Fe3+、CO2、NO3-
D.1 mol·L-1盐酸溶液:Ca2+、Na+、HCO3-、NO3-
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是
A.Fe与稀H2SO4反应:2Fe + 6H+ = 2Fe3+ + 3H2↑
B.硫酸铜溶液与氢氧化钡溶液反应 :Ba2++ SO42― = BaSO4↓
C.氧化铜溶于硫酸:O2―+2H+ = H2O
D.NaCl溶液与AgNO3溶液反应:Ag++Cl―= AgCl↓
难度: 中等查看答案及解析
-
离子方程式BaCO3 + 2H+ = CO2↑ + H2O + Ba2+ 中的H+不能代表的物质是
⑴HCl;⑵H2SO4;⑶HNO3;⑷NaHSO4;⑸CH3COOH
A.⑴⑶ B.⑴⑷⑸ C.⑵⑷⑸ D.⑴⑸
难度: 中等查看答案及解析
-
通过加入适量的化学药品,采用恰当的分离提纯方法,除去某溶液里溶解的杂质,下列做法中不正确的是(括号内的物质为杂质)
A
KCl溶液(CaCl2)
加K2CO3溶液,过滤,再加适量盐酸
B
NaNO3溶液(AgNO3)
加适量NaCl溶液,过滤
C
NaCl溶液(I2)
加酒精,分液
D
KBr溶液(Br2)
加CCl4,分液
难度: 中等查看答案及解析
-
对于溶液中某些离子的检验及结论一定正确的是
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水,溶液变浑浊,一定有CO32-
B.加入氯化钡溶液有白色沉淀产生,再加
盐酸,沉淀不消失,一定有SO42-
C.加入足量稀盐酸,无现象,再加入氯化钡溶液后有白色沉淀产生,一定有SO42-
D.加入碳酸钠溶液产生白色沉淀,再加盐酸沉淀消失,一定有Ba2+
难度: 中等查看答案及解析
-
某硫酸铝溶液密度为1.28g·cm-3,其中铝离子的质量分数为5.3%,200mL该溶液中SO42-离子的物质的量约等于
A.0.21mol B.0.35mol C.0.5mol D.0. 75mol
难度: 中等查看答案及解析