-
下列措施不符合节能减排的是( )
A. 大力发展火力发电,解决电力紧张问题
B. 在屋顶安装太阳能热水器为居民提供生活用热水
C. 用石灰对煤燃烧后形成的烟气脱硫,并回收石膏
D. 用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,作家庭燃气
难度: 简单查看答案及解析
-
下列离子方程式不正确的是( )
A. Na2CO3溶液与足量盐酸反应:CO
+2H+===CO2↑+H2O
B. FeCl2溶液和Cl2反应:2Fe2++Cl2===2Fe3++2Cl-
C. 钠与水反应:Na+H2O===Na++OH-+H2↑
D. NaHCO3溶液与稀硝酸反应:HCO
+H+===CO2↑+H2O
难度: 简单查看答案及解析
-
为检验某FeCl2溶液是否变质,可取少许溶液,向其中加入( )
A. 石蕊溶液 B. 铁片 C. KSCN溶液 D. NaOH溶液
难度: 简单查看答案及解析
-
下列各组离子能在溶液中大量共存的是( )
A. Na+、Ag+、AlO
、Br- B. H+、Fe2+、SO
、NO
C. K+、NH
、CO
、OH- D. Ca2+、Al3+、NO
、Cl-
难度: 简单查看答案及解析
-
科学家于2000年合成了第116号元素(元素符号Lv).有关新质量数为293的Lv原子的描述错误的是( )
A. 质子数116 B. 中子数177 C. 电子数116 D. 该原子可表示为:
Lv
难度: 简单查看答案及解析
-
关于元素周期律和元素周期表的下列说法,正确的是()
A. 目前发现的所有元素占据了周期表里全部位置,不可能再有新的元素被发现
B. 元素的性质随着原子序数的增加而呈周期性变化
C. 俄国化学家道尔顿为元素周期表的建立做出了巨大的贡献
D. 同一主族的元素从上到下,金属性呈周期性变化
难度: 中等查看答案及解析
-
同种元素的原子和离子,一定具有相同的( )
A. 质子数 B. 中子数 C. 电子数 D. 电子层数
难度: 简单查看答案及解析
-
下列各组微粒具有相同的质子数和电子数的是( )。
A. OH-、H2O、F- B. NH3、NH4+、NH2-
C. H3O+、NH4+、NH2- D. HCl、F2、H2S
难度: 中等查看答案及解析
-
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是
A. X的气态氢化物比Y的稳定
B. W的最高价氧化物对应水化物的酸性比Z的强
C. Z的非金属性比Y的强
D. X与Y形成的化合物都易溶于水
难度: 中等查看答案及解析
-
下列排列顺序不正确的是
A. 离子半径:Al3+<Mg2+<F-<O2- B. 热稳定性:SiH4>NH3>H2O>HF
C. 酸性:H2SiO3<H3PO4<H2SO4<HClO4 D. 碱性:KOH>NaOH>Mg(OH)2>Al(OH)3
难度: 中等查看答案及解析
-
下列分子的电子式书写正确的是( )
A. MgCl2
B. CCl4
C. CO2
D. Na2O
难度: 简单查看答案及解析
-
常温下,1mol化学键分解成气态原子所需要的能量用E表示,结合表中信息判断下列说法不正确的是( )
共价键
H-H
F-F
H-F
H-Cl
H-I
E(kJ·mol−1)
436
157
568
432
298
A. 表中最稳定的共价键是H-F
B. 1mol H2(g)与1mol F2(g)生成2molHF(g)放出25kJ的能量
C. 432kJ·mol−1>E(H-Br)>298kJ·mol−1
D. 1mol H2(g)分解成2mol H(g) 需吸收436kJ的能量
难度: 中等查看答案及解析
-
用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是( )
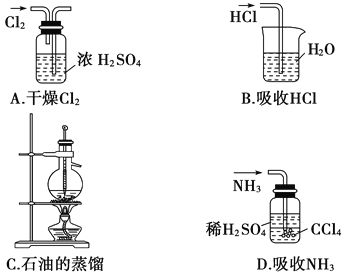
难度: 中等查看答案及解析
-
在A1C13和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的体积和所得沉淀的物质的量的关系如图所示(b处NaOH的体积为l L)
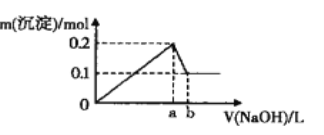
则下列判断正确的是
A. 图中线段oa:ab=3:l B. NaOH溶液物质的量浓度为0.6 mol·L-1
C. 在b点处溶液中的溶质只有NaAlO2 D. 混合溶液中Al3+与Mg2+物质的量比值为2:1
难度: 简单查看答案及解析

