-
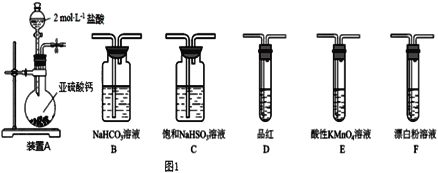
下列选用的仪器和药品能达到实验目的的是
A
B
C
D
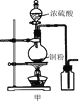


制取并收集二氧化硫
蒸馏时的接收装置
装置中X若为CCl
,可用于吸收NH3或HCl,并防止倒吸
记录滴定终点读数为12.20 mL
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
中学化学常用的酸碱指示剂酚酞的结构简式如图所示,下列关于酚酞的说法不正确的是

A. 酚酞具有弱酸性,且属于芳香族化合物
B. 酚酞的分子式为C20H12O4
C. 1mol酚酞最多与2 molNaOH发生反应
D. 酚酞在碱性条件下能够发生水解反应,呈现红色
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A. 28 g乙烯与丙烯的混合气体中含有双键数目为NA
B. 标准状况下,22.4 L甘油中含有羟基的数目为3 NA
C. 1L 0.1mol·L-1 NaHS溶液中,HS-与S2-数目之和为0.1 NA
D. 0.2 molCl2与0.1 molCH4充分反应,生成HCl分子数为0.2 NA
难度: 困难查看答案及解析
-
某同学做如下实验:
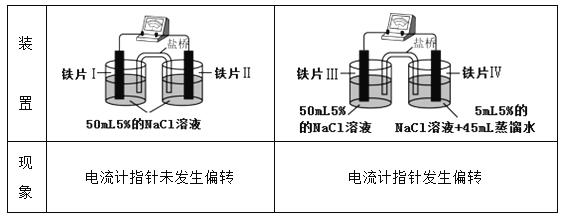
下列说法正确的是
A. “电流计指针未发生偏转”,说明铁片I、铁片II均未被腐蚀
B. 用K3[Fe(CN)6]溶液检验铁片III、IV附近溶液,可判断电池的正、负极
C. 铁片I、III所处的电解质溶液浓度相同,二者的腐蚀速率相等
D. 铁片IV的电极反应式为Fe-3e-=Fe3+
难度: 困难查看答案及解析
-
短周期元素元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构.下列推测不正确的是
A. 同周期元素中X的金属性最强
B. 原子半径X>Y,离子半径X+>Z2-
C. 同族元素中Z的氢化物稳定性最高
D. 同周期元素中Y的最高价含氧酸的酸性最强
难度: 简单查看答案及解析
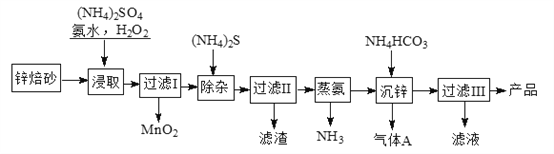

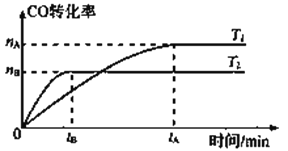
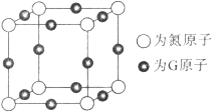
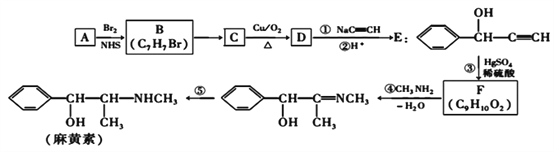
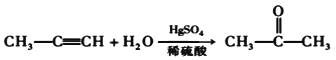
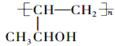 的合成路线,其它试剂及溶剂任选___________________。
的合成路线,其它试剂及溶剂任选___________________。