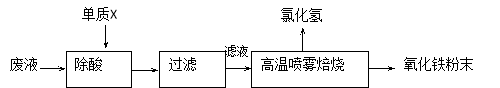
-
下列说法正确的是:
A.石油分馏和煤的干馏都是物理变化
B.塑料和蚕丝都是天然高分子化合物
C.淀粉和纤维素水解的最终产物都是葡萄糖
D.易溶于汽油、酒精、苯的物质一定是有机物
难度: 中等查看答案及解析
-
无色透明的酸性溶液中,能大量共存的是
A.Na+、K+、CO32-、NO3- B.K+、Fe2+、NH4+、NO3-
C.NH4+、Al3+、SO42-、NO3- D.K+、Na+、NO3-、OH-
难度: 中等查看答案及解析
-
下列实验中,所加固体可以完全溶解的是
A.在H2O2溶液中加入少量MnO2粉末
B.将一小块铝片投入足量NaOH溶液中
C.将少量氢氧化铝加入足量的浓氨水中
D.常温下将一小块铁片投入足量的浓硝酸中
难度: 中等查看答案及解析
-
在短周期中,R原子最外层电子数是其次外层电子数的3倍,下列说法不正确的是
A.原子半径大小:X >Y>Z
B.氢化物的稳定性:X >Y
C.化合物YR2能使品红溶液褪色
D.X、Y、Z三种元素最高价氧化物的水化物的酸性最强的是Z
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数,下列叙述正确的是
A.1mol•L-1 NaHCO3溶液中的Na+数为NA
B.常温时,2.24LCO2所含的氧原子数为0.2NA
C.5.6g Fe与足量稀盐酸反应,转移电子数为0.2NA
D.标准状况下,2.24L CCl4所含分子数为0.1NA
难度: 中等查看答案及解析
-
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
选项
叙述I
叙述II
A
NH4Cl为强酸弱碱盐
加热可除去NaCl中的NH4Cl
B
Fe3+具有氧化性
用KSCN溶液可以鉴别Fe3+
C
溶解度:CaCO3<Ca(HCO3)2
溶解度:Na2CO3<NaHCO3
D
SiO2可与HF反应
氢氟酸不能保存在玻璃瓶中
难度: 中等查看答案及解析
-
常温下,Na2CO3溶液中存在平衡:CO32-+H2O
HCO3-+OH-,下列有关该溶液的说法正确的是
A.离子浓度:c(Na+)>c(CO32-)>c(OH-)>c(H+) B.升高温度,平衡向右移动
C.滴入CaCl2浓溶液,溶液的pH增大 D.加入NaOH固体,溶液的pH减小
难度: 中等查看答案及解析
-
下述实验设计能够达到目的的是
选项
实验目的
实验设计
A
证明Ksp(AgCl)﹥Ksp(AgI)
往AgCl悬浊液中滴入KI浓溶液
B
除去Cu粉中的CuO
向混合物中滴加适量稀硝酸
C
检验溶液中是否含有Fe2+
向溶液中滴入KSCN溶液,再滴加氯水
D
证明H2CO3酸性比H2SiO3强
Na2CO3和SiO2在高温下熔融反应
难度: 中等查看答案及解析