-
对下列物质进行的分类正确的是( )
A.纯碱、烧碱均属于碱
B.CuSO4•5H2O属于纯净物
C.凡能电离出H+的化合物均属于酸
D.盐类物质一定含有金属阳离子难度: 中等查看答案及解析
-
在三个密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的顺序是( )
A.p(Ne)>p(H2)>p(O2)
B.p(O2)>p(Ne)>p(H2)
C.p(H2)>p(O2)>p(Ne)
D.p(H2)>p(Ne)>p(O2)难度: 中等查看答案及解析
-
下列实验操作均要用玻璃棒,其中玻璃棒的作用及其目的相同的是( )
①过滤 ②蒸发 ③溶解 ④向容量瓶转移液体.
A.①和②
B.①和③
C.③和④
D.①和④难度: 中等查看答案及解析
-
下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是( )
A.氢氧化钠与盐酸;氢氧化钠与碳酸
B.BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与H2SO4溶液
C.Na2CO3溶液与硝酸溶液;CaCO3溶液与硝酸溶液
D.石灰石与硝酸反应;石灰石与盐酸难度: 中等查看答案及解析
-
下列变化必须需要加入还原剂才能实现的( )
A.MnO4→Mn2+
B.HCl→Cl2
C.Fe→Fe3+
D.KClO3→O2难度: 中等查看答案及解析
-
物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当溶液体积比为3:2:1时,三种溶液中Cl-的物质的量之比为( )
A.1:1:1
B.1:2:3
C.3:2:1
D.3:4:3难度: 中等查看答案及解析
-
在相同条件下,等质量的H3和H2相同的是( )
A.原子数
B.分子数
C.体积
D.物质的量难度: 中等查看答案及解析
-
在相同条件下,两种物质的量相同的气体必然( )
A.体积均为22.4L
B.具有相同的体积
C.是双原子分子
D.具有相同的原子数目难度: 中等查看答案及解析
-
有关氧化还原反应实质的说法中正确的是( )
A.是否有元素的化合价的变化
B.是否有电子转移
C.是否有氧元素的参加
D.是否有原子的重新组合难度: 中等查看答案及解析
-
下列关于胶体的叙述正确的是( )
A.胶体不稳定,静置后容易产生沉淀
B.胶体不均一不透明
C.溶液中溶质粒子不能通过半透膜,胶体中分散质粒子能透过半透膜
D.胶体与其他分散系的本质区别是分散质粒子直径在1nm~100nm之间难度: 中等查看答案及解析
-
下列说法正确的是( )
A.1mol氧
B.SO42-的摩尔质量是96g
C.3mol小麦
D.标准状况下,1molO2和N2混合气体的体积约为22.4L难度: 中等查看答案及解析
-
下列反应中,不属于四种基本反应类型,但属于氧化还原反应的是( )
A.2Na+2H2O=2NaOH+H2↑
B.CH4+2O2CO2+2H2O
C.2KClO32KCl+3O2↑
D.CaCO3+2HCl=CaCl2+H2O+CO2↑难度: 中等查看答案及解析
-
下列操作中,完全正确的是( )
①蒸馏时,温度计水银球应浸没在液体中
②给盛有液体的体积超过容积2/3的试管加热
③把鼻孔靠近容器口去闻气体的气味
④把试管平放,用纸槽往试管里送入固体粉末,然后缓慢竖立试管
⑤用坩埚钳夹取加热后的蒸发皿
⑥将胶头滴管垂直伸进试管内滴加液体
⑦分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出.
A.①④⑤
B.②⑤⑥
C.④⑤⑦
D.⑤⑥⑦难度: 中等查看答案及解析
-
下列各组可用同种方法除去杂质(括号内物质)的是( )
A.植物油(水)与乙醇(水)
B.Fe(OH)3胶体(NaCl)与淀粉溶液(NaCl)
C.泥水(淀粉溶液)与Fe(OH)3胶体(FeCl3)
D.氧化钙(碳酸钙)与NaHCO3(Na2CO3)难度: 中等查看答案及解析
-
下列电离方程式,书写正确的是:( )
A.Al2(SO4)3=2Al3++3SO42─
B.AlCl3=Al3++Cl3─
C.C2H5OH=C2H5O─+H+
D.NaHCO3=Na++H++CO32─难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.铜丝能导电,所以铜是电解质
B.氯化钠晶体不导电,所以氯化钠不是电解质
C.氯化氢水溶液能导电,所以氯化氢是电解质
D.SO3溶于水能导电,所以SO3是电解质难度: 中等查看答案及解析
-
下列可以大量共存且溶液是无色的离子组是( )
A.Fe3+、Na+、Cl─、SO42─
B.Ba2+、Fe2+、Cl─、SO42─
C.NO3-、SO42-、K+、Mg2+
D.H+、K+、OH-、NO3─难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是( )
A.澄清的石灰水与稀盐酸反应Ca(OH)2+2H+=Ca2++2H2O
B.碳酸钙溶于稀盐酸中CO32─+2H+=CO2↑+H2O
C.碳酸氢钠溶液与盐酸反应HCO3-+H+=CO2↑+H2O
D.铜片插入硝酸银溶液中Cu+Ag+=Cu2++Ag难度: 中等查看答案及解析
-
在反应:2H2S+SO2=3S↓+2H2O中,被氧化与被还原的硫原子数之比( )
A.1:1
B.1:2
C.3:2
D.2:1难度: 中等查看答案及解析
-
已知m mol某气体的质量为a g,则b g该气体在标准状况下的体积(L)为( )
A.
B.
C.
D.难度: 中等查看答案及解析
-
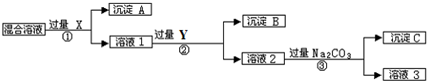
用右图表示的一些物质或概念之间的从属或包含关系中错误的是( )
X Y Z 例 氧化物 化合物 纯净物 A 溶液 分散系 混合物 B 铜 金属元素 元素 C 强电解质 电解质 化合物 D 置换反应 氧化还原反应 离子反应
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
关于某无色溶液中所含离子的鉴别,下列判断正确的是( )
A.加入AgNO3溶液,生成白色沉淀,可确定Cl─存在
B.加入稀盐酸无明显现象,再加BaCl2溶液生成白色沉淀,可确定SO42─存在
C.加入BaCl2溶液,生成白色沉淀,可确定SO42-存在
D.某固体加入盐酸,生成的气体能使澄清石灰水变浑浊,则该固体中一定含有CaCO3难度: 中等查看答案及解析
-
100mL 0.3mol/L K2SO4溶液和100mL 0.2mol/L Al2(SO4)3溶液混合后,溶液中SO42─ 的物质的量浓度为(忽略溶液混合时的体积变化)( )
A.0.30mol/L
B.0.25mol/L
C.0.50mol/L
D.0.45mol/L难度: 中等查看答案及解析
-
硫酸钾和硫酸铝的混合溶液,已知其中Al3+的浓度为0.4mol/L,硫酸根离子浓度为0.7mol/L,则K+的物质的量浓度为( )
A.0.1mol/L
B.0.15mol/L
C.0.3mol/L
D.0.2mol/L难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数,下列叙述正确的是( )
A.22.4L的N2和CO所含分子数均为NA
B.1.7gH2O2中含有的电子数为0.9NA
C.标准状况下,11.2LH2O含有的分子数为0.5NA
D.含有NA个氦原子的氦气在标准状况下的体积约为11.2L难度: 中等查看答案及解析