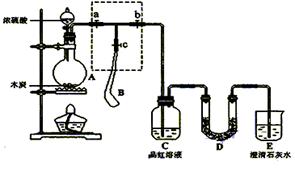
-
[s1] 下列做法不能体现低碳生活的是 ( )
A.减少食物加工过程 B.注意节约用电
C.尽量购买本地的、当季的食物 D.大量使用薪柴为燃料
[s1]1.
难度: 极难查看答案及解析
-
[s1] 节能减排对发展经济、保护环境有重要意义。下列措施不能减少二氧化碳排放的是( )
A.利用太阳能制氢 B.关停小火电企业
C.举行“地球一小时”熄灯活动 D.推广使用煤液化技术
[s1]2.
难度: 极难查看答案及解析
-
3.
难度: 极难查看答案及解析
-
[s1] 下列关于金属元素的叙述正确的是 ( )
A.金属元素单质只有还原性,其离子只有氧化性
B.金属元素的单质在常温下均为固体
C.金属元素在不同化合物中化合价均相同
D.金属元素的单质均为电的良导体
[s1]4.
难度: 极难查看答案及解析
-
[s1] 向某溶液中加入含Fe2+的溶液后,溶液颜色无明显变化。当再滴入几滴新制氯水后,混合液变成血红色,则下列结论中错误的是 ( )
A.原溶液中一定含有SCN- B.氧化性:Fe3+ >Cl2
C.Fe2+与SCN-不能形成红色物质 D.Fe2+被氧化为Fe3+
[s1]5.
难度: 极难查看答案及解析
-
[s1] 下列推断正确的是 ( )
A.SiO2 是酸性氧化物,能与NaOH溶液反应
B.Na2O、Na2O2组成元素相同,与 CO2反应产物也相同
C.CO、NO、 NO2都是大气污染气体,在空气中都能稳定存在
D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
[s1]6.
难度: 极难查看答案及解析
-
[s1] 某些化学试剂可用于净水。净水处理中使用的一种无机高分子混凝剂的化学式可表示为[Al2(OH)nClm·yH2O]x,式中m等于 ( )
A.3-n B.6-n C.6+n D.3+n
[s1]7.
难度: 极难查看答案及解析
-
[s1] 设NA为阿伏加德罗常数,下列叙述正确的是 ( )
A.1mol NaHSO4晶体中含有的离子总数是3NA
B.含10NA个电子的氨气中,氢原子数目为3NA
C.标准状况下,NA个水分子所占的体积约为22.4L
D.46gNO2气体中所含的原子数小于3NA
[s1]8.
难度: 极难查看答案及解析
-
[s1] 日常生活中常用下列方法处理相关问题,其中不涉及化学变化的是 ( )
A.用明矾净化河水 B.蜂蚁螫咬处涂抹稀氨水以消除疼痛
C.用食醋蒸熏对房间消毒杀菌 D.硫酸钡作X光透视肠胃的药剂
[s1]9.
难度: 极难查看答案及解析
-
[s1] 巳知某溶液中存在较多的H+、SO42-、NO3-,则该溶液中还可能大量存在的离子组是( )
A.Al3+、CH3COO-、Cl- B.Mg2+、Ba2+、Br-
C.Mg2+、Cl-、I- D.Na+、NH4+、Cl-
[s1]10.
难度: 极难查看答案及解析
-
[s1] 有 Al2(SO4)3 ,FeSO4,BaCl2, NaOH四种溶液,将其两两反应,若有一种溶液滴入另两种溶液中均产生了白色沉淀,继续滴加该溶液,原白色沉淀或消失或发生颜色变化,则可推断这一种溶液是 ( )
A.Al2(SO4)3 B.FeSO4
C.BaCl2 D.NaOH
[s1]11.
难度: 极难查看答案及解析
-
[s1] 下列离子方程式书写正确的是 ( )
A.铁跟盐酸反应:2Fe+6H+ 2Fe3++3H2↑
B.碳酸氢钙溶液跟过量氢氧化钠溶液反应:Ca2++HCO3-+OH- CaCO3↓+H2O
C.次氯酸钙溶液中通入过量的CO2;ClO-+H2O+CO2 HCO3-+HClO
D.氯化铝溶液与过量的氨水反应:Al3++4NH3·H2O AlO2-+4NH4++2H2O
[s1]12.
难度: 极难查看答案及解析
-
[s1] 下列说法均摘自某科普杂志,你认为无科学性错误的是 ( )
A.铅笔芯的原料是金属铅,儿童在使用时不可用嘴吮咬铅笔,以免引起铅中毒
B.一氧化碳有毒,生有煤炉的居室,可放置数盆清水,这样可有效地吸收一氧化碳,防 止煤气中毒
C.“汽水”浇灌植物有一定的道理,其中二氧化碳的缓释,有利于作物的光合作用
D.硅的提纯与应用,促进了半导体元件与集成芯片业的发展,硅也是光导纤维的主要成分
[s1]13.
难度: 极难查看答案及解析
-
[s1] 正确的实验操作是实验成功的重要因素,下列实验操作错误的是 ( )
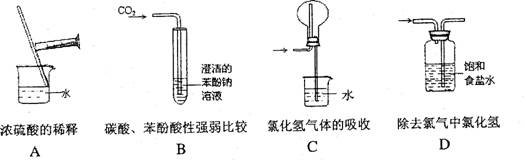
[s1]14.
难度: 极难查看答案及解析
-
[s1] 对某酸性溶液(可能含有Br-,SO42-,H2SO3,NH4+)分别进行如下实验 ( )
①加热时放出的气体可以使品红溶液褪色
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;
③加入氯水时,溶液略显黄色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸
对于下列物质不能确认其在溶液中是否存在的是
A.Br- B.SO42- C.H2SO3 D.NH4+
[s1]15.
难度: 极难查看答案及解析
-
[s1] 用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U型管的质量差,实验测得m(H)∶m(O)>1∶8。下列对导致这一结果的原因的分析中,一定错误的是 ( )
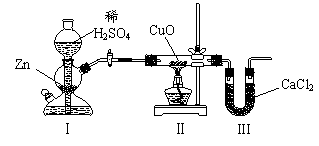
A.Ⅰ、Ⅱ装置之间缺少干燥装置 B.III装置后缺少干燥装置
C.Ⅱ装置中玻璃管内有水冷凝 D.CuO没有全部被还原
[s1]16.
难度: 极难查看答案及解析
-
[s1] 有15mL 2mol·L-1的H2SO4溶液与15mL 3 mol·L-1的Na2CO3溶液,欲使其反应产生CO2的量最多,则正确的操作是 ( )
A.把两种溶液快速混合并不断搅拌
B.把两种溶液缓慢混合并不断搅拌
C.把Na2CO3溶液滴加到H2SO4溶液中
D.把H2SO4溶液滴加到Na2CO3溶液中
[s1]17.
难度: 极难查看答案及解析
-
[s1] 过量铁跟一定量硝酸反应最终生成硝酸亚铁, 下列图象是表示铁和反应过程中生成的硝酸铁之间的物质的量(mol)的关系, 其中正确的是 ( )
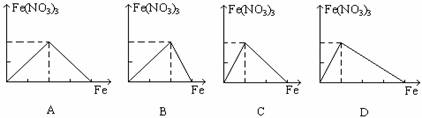
[s1]18.
难度: 极难查看答案及解析
-
[s1] 在铁与铜的混合物中,加入一定量的稀硝酸,充分反应后剩余金属m1g,再向其中加入一定量的稀硫酸,充分振荡后,剩余金属m2g,则m1与m2之间的关系是 ( )
A.m1一定大于m2 B.m1可能等于m2
C.m1一定等于m2 D.m1可能大于m2
[s1]19.
难度: 极难查看答案及解析
-
[s1] 已知:①硫酸比次氯酸稳定 ②硫酸的酸性弱于高氯酸 ③H2S 比HCl易被氧化 ④HCl比 H2S更容易由单质合成⑤盐酸的酸性比氢硫酸强。⑥硫不溶于水,而氯气溶于水⑦通常状态下硫为淡黄色晶体,而氯气为黄绿色气体 ⑧在与金属形成的化合物中硫为-2价,而氯为-1价 ⑨在跟同一金属(如Cu或Fe)反应时,金属被硫氧化成低价态,被氯氧化成高价态。上述事实能说明硫的非金属性比氯弱的是 ( )
A.②③④⑨ B.③④⑤⑦⑧⑨ C.②③④⑧⑨ D.①③⑤⑧
[s1]20.
难度: 极难查看答案及解析
-
[s1] 下列处理事故的方法正确的是 ( )
A.金属钠着火,可用水扑灭
B.误食硫酸铜溶液,可服用鸡蛋清解毒
C.浓硫酸溅到皮肤上,立即用碳酸钠稀溶液冲洗
D.氢氧化钠浓溶液溅入眼中,应立即用大量水冲洗,再用稀盐酸冲洗
[s1]21.
难度: 极难查看答案及解析
-
[s1] m g铁粉与含有H2SO4的CuSO4溶液完全反应后,得到m g铜,则参与反应的H2SO4与CuSO4的物质的量之比为 ( )
A.1 :7 B.7 :1 C.7 :8 D.8 :7
[s1]22.
难度: 极难查看答案及解析
-
[s1] 下列除去杂质的方法正确的是 ( )
A.除去CO2中混有的CO:用澄清石灰水洗气
B.除去BaCO3固体中混有的BaSO4:加过量盐酸后,过滤、洗涤
C.除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤
D.除去Cu粉中混有的CuO:加适量稀硝酸后,过滤、洗涤
[s1]23.
难度: 极难查看答案及解析
-
[s1] 下列所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
a
b
c
A
Al
AlCl3
Al(OH)3
B
HNO3
NO
NO2
C
Si
SiO2
H2SiO3
D
CH2=CH2
CH3CH2OH
CH3CHO
[s1]24.
难度: 极难查看答案及解析
-
[s1] 某钠盐溶液中可能含有
等阴离子。某同学取5份此溶液样品,分别进行了如下实验:
①用pH计测得溶液pH大于7
②加入盐酸,产生有色刺激性气体
③加入硝酸酸化的AgNO3溶液产生白色沉淀,且放出有色刺激性气体
④加足量BaCl2溶液,产生白色沉淀,该沉淀溶于稀硝酸且放出气体,将气体通入品红溶液,溶液不褪色。
⑤加足量BaCl2溶液,产生白色沉淀,在滤液中加入酸化的(NH4)2Fe(SO4)溶液,再滴加KSCN溶液,显红色
该同学最终确定在上述六种离子中公含
三种阴离子。
请分析,该同学只需要完成上述哪几个实验,即可得出此结论。
A.①②④⑤ B.③④ C.③④⑤ D.②③⑤
[s1]25.
难度: 极难查看答案及解析
-
[s1] 有一种白色粉末由等质量的两种物质混合而成,分别取适量该白色粉末置于三支试管中进行实验。
(1)逐滴加入6mol·L-1盐酸,同时不断振荡试管,有气泡产生,反应结束后得到无色透明溶液
(2)加热试管中的白色粉末,试管口有水滴凝结
(3)逐滴加入6mol·L-1硫酸,同时不断振荡试管,有气泡产生,反应结束后试管中还有白色不溶物
下列混合物中符合以上实验现象的是 ( )
A.NaHCO3、AgNO3 B.BaCl2、MgCO3
C.NH4HCO3、MgCl2 D.CaCl2·6H2O、Na2CO3
[s1]26.
难度: 极难查看答案及解析