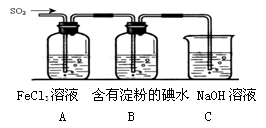
-
下列有关化学实验的叙述正确的是
A.用待测液润洗滴定用的锥形瓶
B.配制FeCl3溶液时,向溶液中加入少量Fe和稀盐酸
C.用稀硝酸酸洗涤盛做过银镜反应的试管
D.液溴保存时液面覆盖一层水,装在带橡胶塞的试剂瓶中
难度: 中等查看答案及解析
-
设nA是阿伏加德罗常数的数值。下列说法正确的是
A.1L 0.1mol·L-1的FeCl3溶液中,Fe3+的数目为0.1nA
B.1molNH3中含有N-H键的数目为3nA
C.7.8g Na2O2中含有的阳离子数目为0.1nA
D.标准状况下,22.4L水中分子个数为nA
难度: 中等查看答案及解析
-
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示。
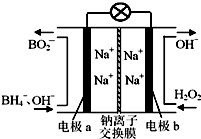
下列说法正确的是
A.电池放电时Na+从a极区移向b极区
B.每消耗3 mol H2O2,转移的电子为3 mol
C.电极a采用MnO2,MnO2既作电极材料又有催化作用
D.该电池的负极反应为:BH4-+2H2O-8e-=== BO2-+8H+
难度: 中等查看答案及解析
-
甲、乙、丙、丁是由H+、Na+、Al3+、Ba2+、OH—、Cl—、HCO3—离子中的两种组成,可以发生如图转化,下列说法正确的是
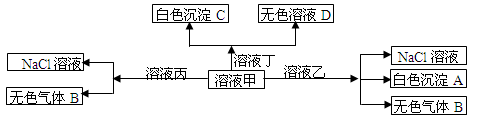
A.甲为AlCl3,乙为NaHCO3
B.溶液丙中还可以大量共存的离子有:Fe2+、NO3—、SO42—
C.在甲中滴加丁开始反应的离子方程式:HCO3—+ Ba2++OH—= BaCO3↓+ H2O。
D.白色沉淀A可能溶解在溶液D中。
难度: 困难查看答案及解析
-
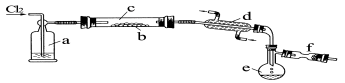
化学是以实验为基础的学科,下列有关实验的描述正确的是
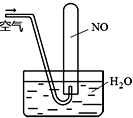
A.向两支分别装有碳酸钠和碳酸氢钠固体的试管中各加几滴水,前者温度降低,后者温度升高
B.向100mL容量瓶中加入4.0gNaOH固体,然后加水到刻度线,配制1.0mol/L的NaOH溶液
C.向酸性重铬酸钾溶液中加NaOH,溶液颜色由橙色慢慢变为黄色
D.如图所示,随着空气的通入,试管内液面会慢慢上升至充满整支试管,而后液面又下降。
难度: 中等查看答案及解析
-
下列反应的离子方程式不正确的是
A.碳酸氢钙溶液加入过量的氢氧化钙溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
B.等物质的量的NH4HCO3与NaOH在溶液中反应:NH4++OH-=NH3·H2O
C.在含有Mn2+的溶液中加入HNO3酸化,再加入PbO2,反应体系显紫红色:5PbO2 + 2Mn2+ + 4H+ = 5Pb2+ + 2MnO4— + 2H2O
D.等体积同浓度NaHSO4、Ba(OH)2两溶液混合:H++SO42—+Ba2++OH—=BaSO4↓+H2O
难度: 困难查看答案及解析
-
原电池发生的反应是可自发进行的氧化还原反应,CO/O2燃料电池以熔融状态的碳酸盐为电解质,下列说法正确的是
A.CO在正极通入
B.CO32— 在电池内部向正极移动
C.当有22.4LCO参加反应时电路中有2mol电子发生转移
D.该电池电解质在固态时,电池无法工作
难度: 中等查看答案及解析
-
下列根据实验操作和现象所得出的结论正确的是
选项
实验操作
实验现象
结论
A
向两份蛋白质溶液中分别滴加饱和NaCl 溶液和CuSO4 溶液
均有固体析出
蛋白质均发生变性
B
向溶液X 中先滴加稀硝酸,再滴加Ba(NO3)2溶液
出现白色沉淀
溶液X 中一定含有SO42-
C
用大理石和盐酸反应制取CO2 气体,立即通入一定浓度的Na2SiO3 溶液中
出现白色沉淀
H2CO3的酸性比H2SiO3的酸性强
D
向浓度均为0. 1 mol·L-1 NaCl 和NaI 混合溶液中滴加少量AgNO3 溶液
出现黄色沉淀
Ksp(AgCl)>Ksp(AgI)
难度: 中等查看答案及解析
-
在15.2g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成气体X,再向所得溶液中加入足量的NaOH溶液,生成25.4g沉淀,则下列表示气体X组成的选项中合理的是
A.0.3 mol NO2、0.1 mol NO B.0.3 mol NO、0.1 mol NO2
C.0.6 mol NO D.0.3 mol NO2
难度: 中等查看答案及解析
-
下列离子能在溶液中大量共存的是
A.Na+、NH4+、CO32-、Br- B.Fe2+、H+、ClO-、Cl-
C.Al3+、Ca2+、HCO3-、SO42- D.Fe3+、Cu2+、NO3-、OH-
难度: 中等查看答案及解析
-
某同学通过系列实验探究Mg及其化合物的性质,操作正确且能达到目的的是
A.将水加入浓硫酸中得到稀硫酸,置镁条于其中探究Mg的活泼性
B.将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成
C.将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀
D.将Mg(OH)2沉淀转入蒸发皿中,加足量稀盐酸,加热蒸干得无水MgCl2固体
难度: 中等查看答案及解析
-
下列陈述Ⅰ、Ⅱ都正确并且有因果关系的是
选项
陈述Ⅰ
陈述Ⅱ
A
浓硫酸有强氧化性
浓硫酸不能用于干燥H2S和HI气体
B
NH4Cl为强酸弱碱盐
用加热法除去NaCl中的NH4Cl
C
溶解度:CaCO3<Ca(HCO3)2
溶解度:Na2CO3<NaHCO3
D
SiO2是两性氧化物
SiO2能与NaOH溶液和氢氟酸反应
难度: 中等查看答案及解析