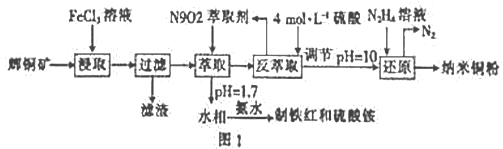
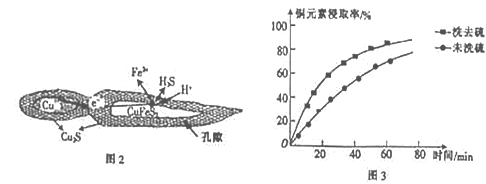
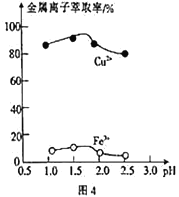
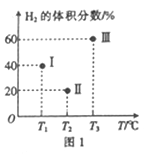
-
化学与生产生活密切相关。下列说法错误的是
A. 生活污水进行脱氮脱磷处理可以减少水体富营养化
B. 增加炼铁高炉烟囱高度可以减小尾气中CO的浓度
C. 用臭氧杀灭地下害虫具有高效及环保等优点
D. 将装有硅胶和铁粉的小袋放入食品透气袋里,可防止食物受潮、氧化变质
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的数值,下列说祛正确的是
A. 24g Mg与足量N2反应生成Mg3N2,转移的电子数为6NA
B. lmol Na218O2中所含的中子数为42NA
C. 9.8g由H2SO4和H3PO4组成的混合物中含有的氧原子数为0.4NA
D. 1mol环已烷中含有的共价键数为12NA
难度: 中等查看答案及解析
-
曲酸和脱氧曲酸是非常有潜力的食品添加剂具有抗菌抗癌作用,其结构如图所示。下列有关叙述不正确的是
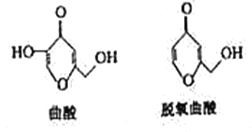
A. 曲酸的分子式为C6H6O4
B. 与脱氧曲酸互为同分异构体的芳香族化合物有4种(不考虑—O—O—键)
C. 曲酸和脱氧曲酸均能使酸性高锰酸钾溶液褪色
D. 脱氧曲酸能发生加成反应和酯化反应
难度: 中等查看答案及解析
-
W、X、Y、Z为原子序数依次增大的短周期不同主族元素,其中只有一种为金属元素,四种元素的单质在通常情况下只有一种不是气体,X与Z的最外层电子数之和为W与Y最外层电子数之和的四倍。下列叙述不正确的是
A. Z的氧化物对应的水化物酸性均比X的强
B. W、X、Z三种元素形成的化合物可能既含离子键又含共价键
C. 原子半径:Y>Z>W
D. 单质的熔点:Y>X>W
难度: 困难查看答案及解析
-
下列实验方案不能达到相应实验目的的是
选项
实验目的
实验方案
A
比较水和乙醇中羟基氢的活泼性
将少量金属钠分别加入水和乙醇中
B
比较HA 和HB两种弱酸的Ka大小
用pH计测定同温同浓度的NaA溶液和NaB溶液的pH
C
检验氯化铁溶液中是否含FeCl2
向氯化铁溶液中滴加KSCN溶液
D
验证Ksp(AgI)<Ksp(AgCl)
向含等物质的量NaCl、KI的混合液中滴加数滴AgNO3溶液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
世界水产养殖协会网介绍了一种利用电化学原理净化鱼池中水质的方法,其装置如图所示。
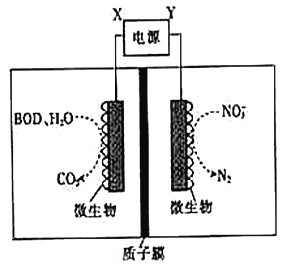
下列说法错误的是
A. X为电源正极
B. 若该装置在高温下进行,则净化效率将降低
C. 若BOD为葡萄糖(C6H12O6),则1mol葡萄糖被完全氧化时,理论上电极上流出24mole-
D. 若有1molNO3-被还原,则有6molH+通过质子膜迁移至阳极区
难度: 困难查看答案及解析
-
25 ℃时,体积均为20 mL、浓度均为0.1 mol • L-1的两种酸HX、HY分别与0.1 mol • L-1的NaOH溶液反应,所加NaOH溶液体积与反应后溶液的-pH的关系如图所示。下列叙述正确的是
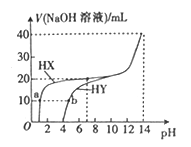
A. a点c(X-)>b点c(Y-) B. HX发生反应的离子方程式为HX+OH-=X-+H2O
C. Ka(HY)的数量级约为10-3 D. pH=7时,两种反应后的溶液中c(Y-)>c(X-)
难度: 中等查看答案及解析