-
下列有关生活和生产中的化学知识描述正确的是( )
A.合成纤维和光导纤维都是有机高分子化合物
B.铝合金的大量使用归功于人们能使用焦炭等还原剂从氧化铝中获得铝
C.发电厂的燃煤在燃烧时加入适量石灰石,有利于环境保护
D.因为食盐能使细菌等蛋白质发生变性,所以用食盐腌制过的食品能较长时间不变质难度: 中等查看答案及解析
-
下列说法错误的是( )
A.0.1mol/L的CH3COOH溶液中,由水电离的c(H+)为10-13 mol/L
B.pH=2与pH=1的CH3COOH溶液中c(H+)之比为1:10
C.等体积pH=12的NaOH溶液和pH=2的CH3COOH溶液混合,混合后溶液pH<7
D.1mol醋酸分子中含有共价键的个数为8NA难度: 中等查看答案及解析
-
自来水生产的流程示意图如下,下列说法错误的是( )

A.混凝剂除去悬浮物质的过程既有物理变化又有化学变化
B.FeSO4•7H2O是常用的混凝剂,它在水中最终生成Fe(OH)2沉淀
C.若要除去水中的Ca2+、Mg2+,可向水中加入石灰后再加入纯碱
D.用臭氧可以替代氯气进行消毒难度: 中等查看答案及解析
-
X、Y、Z、M、N五种常见的短周期元素原子半径随原子序数变化如图.已知X的一种原子的质量数为18,中子数为10;Y和Ne原子的核外电子数相差1;M的单质是一种常见的半导体材料;N的原子半径在同周期主族元素中最小;Y、Z、N三种元素的最高氧化物对应的水化物两两之间可以发生反应.下列说法错误的是( )

A.N、Z两种元素的离子半径相比前者较大
B.M、N两种元素的气态氢化物的稳定性相比后者较强
C.X与Y两种元素组成的一种化合物中阴、阳离子的个数比为1:1
D.工业上用电解Y和N形成的化合物的熔融态制取Y的单质难度: 中等查看答案及解析
-
下列有关反应的离子方程式正确的是( )
A.Fe3O4与过量稀硝酸反应:Fe3O4+8H+=2Fe3++Fe2++4H2O
B.NH4HCO3溶液中逐滴加入少量 NaOH溶液:NH4++OH-=NH3•H2O
C.FeBr2溶液与等物质的量的Cl2反应:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2
D.溴代乙酸与足量氢氧化钠溶液反应:CH2BrCOOH+NaOHCH2BrCOONa+H2O
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是( )
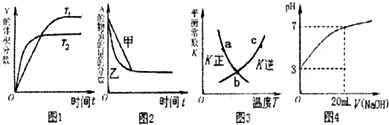
A.图1表示可逆反应“2X(g)⇌Y(g)△H<0”温度T1<T2的情形
B.图2表示压强对可逆反应2A(g)+2B(g)⇌3C(g)+D(s)的影响,乙的压强比甲的压强大
C.图3中a、b、c三点中只有b点已经达到化学平衡状态
D.图4是向20mL pH=3的醋酸溶液中滴加pH=11的NaOH溶液过程中pH变化曲线难度: 中等查看答案及解析
-
下述实验能达到预期目的是( )
编号 实验内容 实验目的 A 将SO2通入酸性KMnO4 溶液中,紫色褪去 证明SO2具有漂白性 B 在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去 证明Na2CO3溶液中存在水解平衡 C 向1mL0.2mol/L NaOH溶液中滴入2滴0.1mol/L的MgCl2溶液产生白色沉淀后,再滴加2滴0.1mol/L的FeCl3溶液,又生成红棕色沉淀 证明在相同温度下,氢氧化镁的溶解度大于氢氧化铁的溶解度 D 测定等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大 证明非金属性S>C
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
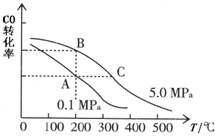
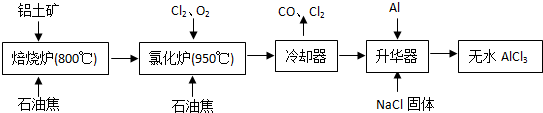
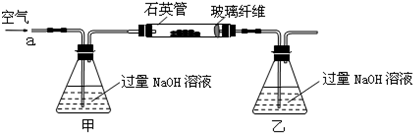
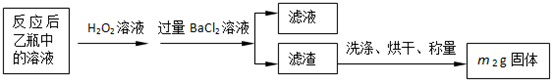
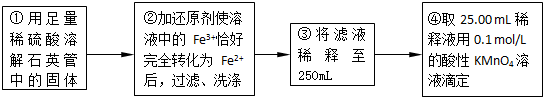
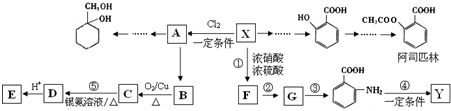
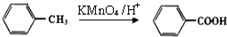

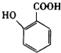 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有______种;
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有______种; 的流程图.
的流程图.