-
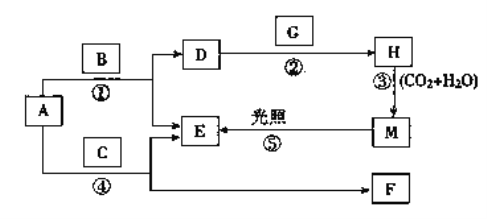
现有A、B、C、D、E、F、G、H、M九种物质,其中A为淡黄色粉末,B为日常生活中最常见无色无味液体, E为无色气体单质,F的水溶液与石灰水混合可得D的溶液,G为黄绿色气体单质,H是漂白液的有效成分,它们之间的相互转化关系如图所示,其他与题无关的生成物均已略去。
请回答下列问题:
(1)写出G、H的化学式:G________,H________。D的俗名是__________。
(2)写出反应②的离子方程式:_________________________________________。
(3)利用下图装置进行实验,证明氧化性强弱:KMnO4>Cl2>Br2。
限选试剂:KBr溶液、KMnO4、浓盐酸。

已知:2KMnO4+16HCl(浓)=2KCl+ 2MnCl2+5Cl2↑+8H2O
请回答下列问题:
装置a 的名称是____________________,d中盛放的试剂是____________。
难度: 简单查看答案及解析
-
铁是人类较早使用的金属之一,铁及其化合物之间的相互转化作用可用下式表示:
I.回答下列有关问题:
(1)向沸水中逐滴滴加1mol/LFeCl3溶液,至液体呈透明的红褐色,形成该分散系的微粒大小范围是______nm。
(2)电子工业需用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,生成FeCl2和CuCl2,制造印刷电路板。写出FeCl3溶液腐蚀铜的化学反应方程式:___________。检验反应后溶液中还存在Fe3+的试剂是__________。
(3)在下列化学方程式中:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O还原剂是______.
II.现有五种溶液,分别含下列离子:①Ag+,②Mg2+,③Fe2+,④Al3+,⑤Fe3+。
(1)写出符合下列条件的离子符号:既能被氧化又能被还原的离子是______,加铁粉后溶液增重的是 _____________(填写离子符号)
(2)向Fe2+的溶液中滴加NaOH溶液,现象是___________________ 。
(3)欲除去FeCl2中FeCl3选用的试剂是________ , 并写出相应离子方程式:__________。
难度: 中等查看答案及解析
-
物质的类别和核心元素的化合价是研究物质性质的两个重要角度。请根据下图所示,回答下列问题:
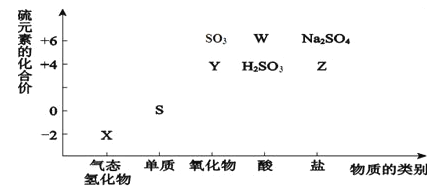
(1)X的化学式为__________,Y的化学式为__________。
(2)W的浓溶液与铜单质在加热条件下可以发生化学反应,反应的化学方程式为_________。
(3)欲制备Na2S2O3,从氧化还原角度分析,合理的是________(填序号)。
A.Na2S + S B.Na2SO3 + S C.Na2SO3 + Na2SO4 D.SO2 + Na2SO4
(4)将X与SO2混合,可生成淡黄色固体。该反应的氧化产物与还原产物的质量之比为_____。
难度: 中等查看答案及解析