-
19世纪中叶,对元素周期律有重大贡献的科学家是
A.勒夏特列 B.门捷列夫 C.道尔顿 D.拉瓦锡
难度: 简单查看答案及解析
-
下列化学用语正确的是:
A.8个中子的碳原子的核素符号:12C B.H2O的电子式:
C.Cl-离子结构示意图:
D.甲烷的结构式:
难度: 简单查看答案及解析
-
下列各组物质中互为同位素的
A.
和
B.D和T
C.H2O和H2O2 D.O3和O2
难度: 简单查看答案及解析
-
某元素X 的气态氢化物的化学式为XH3 ,则X的最高价氧化物的水化物的化学式可能为
A. H2XO3 B. HXO3 C. HXO D. H2XO4
难度: 简单查看答案及解析
-
下列各组物质的性质比较中,正确的是
A. 稳定性:HCl>H2S>H2O B. 碱性:NaOH >KOH>Mg(OH)2
C. 酸性:HClO4>HBrO4>HIO4 D. 还原性:I-﹤Br -﹤Cl-
难度: 简单查看答案及解析
-
已知X、Y、Z都是第三周期元素,且核电荷数依次增大,X的最高价氧化物对应水化物为强碱,Z的原子半径在第三周期(除稀有气体外)最小。据此判断下列说法不正确的是
A.X是ⅠA元素,Z是VIIA元素
B.X、Y、Z三种元素的最高化合价逐渐减小
C.Z的最高价氧化物对应的水化物是强酸
D.X、Z形成的化合物是离子化合物
难度: 简单查看答案及解析
-
下列各组化合物中,化学键类型完全相同的是
A. CaCl2 和 Na2S B . Na2O 和Na2O2 C. CO2 和 CaO D. HCl 和NaOH
难度: 简单查看答案及解析
-
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如下图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是
X
Y
Z
W
A.原子半径: W>Z>Y>X
B.最高价氧化物对应水化物的酸性:Z>W>X
C.气态氢化物的稳定性:Z>W
D.W的单质能与水反应,生成一种具有漂白性的物质
难度: 简单查看答案及解析
-
下列表示电子式的形成过程正确的是:

难度: 简单查看答案及解析
-
元素性质呈周期性变化的决定因素是
A.元素原子半径大小呈周期性变化 B.元素的相对原子质量依次递增
C.元素原子核外电子排布呈周期性变化 D.元素的最高正化合价呈周期性变化
难度: 简单查看答案及解析
-
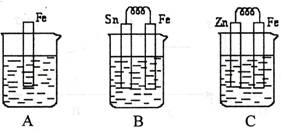
下列各装置能构成原电池的是

难度: 简单查看答案及解析
-
如图是氢氧燃料电池构造示意图。关于该电池的说法不正确的是
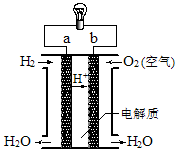
A.a极是负极
B.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
C.电子由b通过灯泡流向a
D.氢氧燃料电池是环保电池
难度: 简单查看答案及解析
-
一学生欲通过实验判断X,Y,Z,W四块金属的活泼性, 做了如下实验并得结论:当X,Y组成原电池时,Y为负极;当Z,W组成原电池时,W为正极;W能将Y从其盐溶液中置换出来,据此可知它们的活泼性顺序是
A. Z>W> X > Y B. Z>W> Y>X C. X>Y>W>Z D. X>Y>Z>W
难度: 简单查看答案及解析
-
下列说法中错误的是
A. 化学反应中的能量变化通常表现为热量的变化
B. 化学键的断裂和形成是化学反应中能量变化的主要原因
C. 需要加热才能发生的反应一定是吸热反应
D. 反应物总能量和生成物总能量的相对大小决定了反应是放出能量还是吸收能量
难度: 简单查看答案及解析
-
下列属于氧化还原反应,且为吸热反应的是
A. CaO+H2O
Ca(OH)2 B. C+H2O
CO+H2
C. 2Al+Fe2O3=====2Fe+Al2O3 D. 2NaOH+H2SO4===Na2SO4+2H2O
难度: 简单查看答案及解析
-
25℃,101kPa时,1g甲醇完全燃烧生成CO2和液态H2O,同时放出22.68kJ热量.下列表示该反应的热化学方程式中正确的是
A.CH4O(l)+3/2O2(g) = CO2(g)+2H2O(l); △H= -725.8kJ/mol
B.2CH4O(l)+3O2(g)= 2CO2(g)+4H2O(l);△H= +1451.6kJ/mol
C.2CH4O+O2 = 2CO2+4H2O(l);△H= -22.68kJ/mol
D. CH4O(l)+3/2O2(g) = CO2(g)+2H2O(g);△H= -725.8kJ/mol
难度: 简单查看答案及解析
-
若甲烷与氯气以物质的量之比1:3混合,在光照下得到的有机产物:⑴CH3Cl, ⑵CH2Cl2,⑶CHCl3,⑷CCl4,其中正确的是
A.只有⑴ B.只有⑶ C.只有⑴⑵⑶ D.⑴⑵⑶⑷都有
难度: 简单查看答案及解析
-
下列属于加成反应的是
A己烯使酸性高锰酸钾溶液褪色。
B、将苯滴入溴水中,振荡后水层接近五色。
C、乙烯使溴水褪色。
D、甲烷与氯气混合光照一段时间后黄绿色消失。
难度: 简单查看答案及解析
-
关于苯的说法正确的是
A、苯使溴水褪色是因为发生了取代反应
B、苯中各原子均在同一平面.
C、苯中没有典型的碳碳双键,所以不能发生加成反应.
D、苯中的含碳量高,燃烧时产生大量的黑烟.
难度: 简单查看答案及解析
-
下列说法正确的是
A、碳碳间以单键结合,碳原子剩余价键全部与氢原子结合的烃一定是饱和链烃
B、分子组成符合CnH2n+2的烃一定是烷烃
C、正戊烷分子中所有原子均在一条直线上
D、碳氢原子个数比为1:3的烃有2种
难度: 简单查看答案及解析
-
某烷烃只能生成一种一氯代物,此烷烃的分子式可以是
A、CH4 B、C3H8 C、C4H10 D、C6H14
难度: 简单查看答案及解析
-
反应4
(气)+5
(气)
4NO(气)+6
(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率
(X)(反应物的消耗速率或产物的生成速率)可表示为
A.
(NH3)=0.0100mol.L-1.s-1 B.
(O2)=0.0010mol.L-1.S-1
C.
(NO)=0.0010mol.L-1.s-1 D.
(H2O)=0.045mol.L-1.s-1
难度: 简单查看答案及解析
-
在一定条件下,反应A2(g)+B2(g)
2AB(g),达到反应限度的标志是
A.容器内气体的总压强不随时间的变化而变化
B.单位时间内有nmolA2生成,同时就有nmolB2生成
C.单位时间内有nmolA2生成,同时就有2nmolAB生成
D.单位时间内有nmolB2生成,同时就有2nmolAB分解
难度: 简单查看答案及解析
-
一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使该反应发生。下列有关说法正确的是:
A.达到化学反应平衡时,生成的NH3为2mol
B.达到化学反应平衡时,N2、H2和NH3的物质的量浓度一定相等
C.达到化学反应平衡时,N2、H2和NH3的物质的量浓度不再变化
D.达到化学反应平衡时,正反应和逆反应的速率都为零
难度: 简单查看答案及解析
-
在反应:C+CO2=2CO中,可使反应速率增大的措施是
①增大压强(缩小体积) ②升高温度 ③通入CO2 (体积不变) ④增加碳的量 ⑤降低压强
A.①②③ B.②③④⑤ C.①②③④ D.②③④
难度: 简单查看答案及解析
-
将4molA气体和2molB气体在2L容器中混合并在一定条件下发生下列反应:2A (g) + B(g)
2C(g) 若2秒钟后测得C的浓度为0.6mol.L-1,则下列说法正确的是
A. 用物质A表示的反应平均速率为0.6mol.L-1.S-1
B. 用物质B表示的反应平均速率为0.6mol.L-1.S-1
C. 2秒钟时,物质A的转化率为70%
D. 2秒钟时,物质B的转化率为30%
难度: 简单查看答案及解析