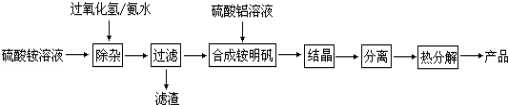
-
钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为:2Fe+2H2O+O2=2Fe2++4OH-下列说法正确的是
A.原电池是将电能转变为化学能的装置
B.正极发生的反应为:2H2O+O2+2e-=4OH-
C.负极发生的反应为:Fe-2e-=Fe2+
D.钢柱在水下部分比在空气与水交界处更容易腐蚀
难度: 简单查看答案及解析
-
下列图示与对应的叙述不相符合的是
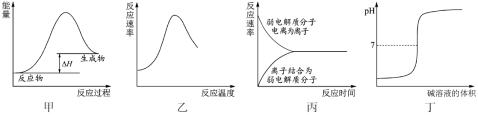
A.图甲表示燃料燃烧反应的能量变化
B.图乙表示酶催化反应的反应速率随反应温度的变化
C.图丙表示弱电解质在水中建立电离平衡的过程
D.图丁表示强碱滴定强酸的滴定曲线
难度: 简单查看答案及解析
-
向含有MgCO3固体的溶液中滴加少许浓盐酸(忽略体积变化),下列数值变小的是
A.c(CO32-
) B.c(Mg2+) C.c(H+) D.Ksp(MgCO3)
难度: 简单查看答案及解析
-
某电池以K2FeO4和Zn为电极材料,KOH溶液为电解溶质溶液。下列说法正确的是
A.Zn为电池的正极
B.正极反应式为2FeO42−+10H++6e−=Fe2O3+5H2O
C.该电池放电过程中电解质溶液浓度不变
D.电池工作时
向负极迁移
难度: 简单查看答案及解析
-
某电动汽车配载一种可充放电的锂离子电池。放电时电池的总反应为:Li1-xCoO2+LixC6=LiCoO2+C6(x<1)。下列关于该电池的说法不正确的是
A.放电时
,Li+在电解质中由负极向正极迁移
B.放电时,负极的电极反应式为LixC6-xe-=xLi++ C6
C.充电时,若转移1 mol e-,石墨C6电极将增重7x g
D.充电时,阳极的电极反应式为LiCoO2-xe-=Li1-xCoO2+xLi+
难度: 中等查看答案及解析
-
一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)
CO(g)+3H2(g),设起始
=Z,在恒压下,平衡时
(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
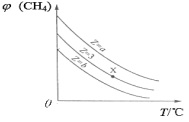
A.该反应的焓变ΔH>0
B.图中Z的大小为a>3>b
C.图中X点对应的平衡混合物中
=3
D.温度不变时,图中X点对应的平衡在加压后
(CH4)减小
难度: 困难查看答案及解析
-
能证明乙酸是弱酸的实验事实是
A.CH3COOH溶液与Zn反应放出H2
B.0.1mol/L CH3COONa溶液的pH大于7
C.CH3COOH溶液与NaCO3反应生成CO2
D.0.1 mol/L CH3COOH溶液可使紫色石蕊变红
难度: 简单查看答案及解析
-
向1 L含0.01 mol NaAlO2和0.02 mol NaOH的溶液中缓慢通入CO2,随n(CO2)增大,先后发生三个不同的反应,当0.01 mol<n(CO2)
0.015时发生的反应是:2NaAlO2+ CO2+3H2O=2Al(OH)3↓+Na2CO3。下列对应关系正确的是
选项
n(CO2)/mol
溶液中离子的物质的量浓度
A
0
c(Na+)>c(AlO2-)+c(OH-)
B
0.01
c(Na+)>c(AlO2-)>c(OH-)>c(CO32-)
C
0.015
c(Na+)>c(HCO3-)>c(CO32-)> c(OH-)
D
0.03
c(Na+)>c(HCO3-)> c(OH-)>c(H+)
难度: 困难查看答案及解析
-
298K时,在20.0mL0.10 mol L–1氨水中滴入0.10 mol L–1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol L–1氨水的电离度为1.32%,下列有关叙述正确的是
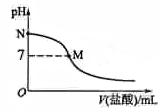
A.该滴定过程应该选择酚酞作为指示剂
B.M点对应的盐酸体积为20.0mL
C.M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D.N点处的溶液中pH<12
难度: 困难查看答案及解析
-
羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:
CO(g)+H2S(g)
COS(g)+H2(g) K=0.1
反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是
A.升高温度,H2S浓度增加,表明该反应是吸热反应
B.通入CO后,正反应速率逐渐增大
C.反应前H2S物质的量为7mol
D.CO的平衡转化率为80%
难度: 中等查看答案及解析
-
下列说法正确的是
A.氢氧燃料电池工作时,H2在负极上失去电子
B.0.1 mol/L Na2CO3溶液加热后,溶液的pH减小
C.常温常压下,22.4 L Cl2中含有的分子数为6.02×1023个
D.室温下,稀释0.1 mol/L CH3COOH溶液,溶液的导电能力增强
难度: 简单查看答案及解析
-
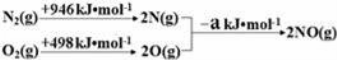
通过以下反应均可获取H2。下列有关说法正确的是
①太阳光催化分解水制氢:2H2O(l)=2H2(g)+O2(g) ΔH1=571.6kJ·mol–1
②焦炭与水反应制氢:C(s)+H2O(g)=CO(g)+H2(g) ΔH2=131.3kJ·mol–1
③甲烷与水反应制氢:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH3=206.1kJ·mol–1
A.反应①中电能转化为化学能
B.反应②为放热反应
C.反应③使用催化剂,ΔH3减小
D.反应CH4(g)=C(s)+2H2(g)的ΔH=74.8kJ·mol–1
难度: 中等查看答案及解析
-
H2C2O4为二元弱酸。20℃配制一组c(H2C2O4)+c(HC2O4–)+c(C2O42–)=0.100 mol·L–1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。一定正确的是
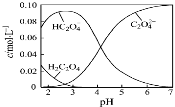
A.pH=2.5的溶液中:c(H2C2O4)+c(C2O42–)>c(HC2O4–)
B.c(Na+)=0.100 mol·L–1的溶液中:c(H+)+c(H2C2O4)=c(OH–)+c(C2O42–)
C.c(HC2O4–)=c(C2O42–)的溶液中:c(Na+)>0.100 mol·L–1+c(HC
2O4–)
D.pH=7的溶液中:c(Na+)<2c(C2O42–)
难度: 极难查看答案及解析
-
一定温度下,在3个体积均为1.0 L的恒容密闭容器中反应2H2(g)+CO(g)
CH3OH(g) 达到平衡。下列说法正确的是

A.该反应的正反应吸热
B.达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
C.达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D.达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.使用催化剂能够降低化学反应的反应热(△H)
B.金属发生吸氧腐蚀时,被腐蚀的速率和氧气浓度无关
C.原电池中发生的反应达平衡时,该电池仍有电流产生
D.在同浓度的盐酸中,ZnS可溶而CuS不溶,说明CuS的溶解度比ZnS的小
难度: 简单查看答案及解析
-
室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断错误的是( )
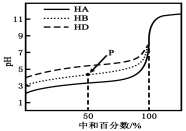
A.三种酸的电离常数关系:KHA>KHB>KHD
B.滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
难度: 困难查看答案及解析
-
K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O
2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
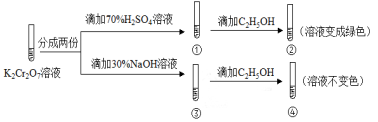
结合实验,下列说法不正确的是
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72-被C2H5OH还原
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
难度: 中等查看答案及解析
-
在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。
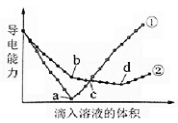
下列分析不正确的是
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH–
C.c点,两溶液中含有相同量的OH–
D.a、d两点对应的溶液均显中性
难度: 困难查看答案及解析
-
锌−空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH–+2H2O=2Zn(OH)42-。下列说法正确的是( )
A.充电时,电解质溶液中K+向阳极移动
B.充电时,电解质溶液
中C(OH-)逐渐减小
C.放电时,负极反应为:Zn+4OH–-2e–=Zn(OH)42-
D.放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)
难度: 中等查看答案及解析
-
下列有关电解质溶液的说法正确的是
A.向0.1mol
CH3COOH溶液中加入少量水,溶液中
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中
增大
C.向盐酸中加入氨水至中性,溶液中
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中
不变
难度: 中等查看答案及解析
-
Mg—AgCl电池是一种以海水为电解质溶液的水激活电池。下列叙述错误的是
A.负极反应式为Mg-2e-=Mg2+
B.正极反应式为Ag++e-=Ag
C.电池放电时Cl-由正极向负极迁移
D.负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑
难度: 简单查看答案及解析
-
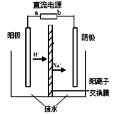
三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是
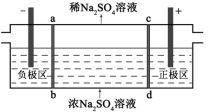
A.通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.负极反应为2H2O − 4e– = O2+4H+,负极区溶液pH降低
D.当电路中通过1mol电子的电量时,会有0.5mol的O2生成
难度: 困难查看答案及解析