-
“绿色化学”中,最理想的“原子经济”是原子利用率为100%。下列反应类型能体现“原子经济”原则的事①取代反应②酯化反应③加成反应④置换反应⑤水解反应⑥化合反应
A.①④ B.②⑤ C.③⑥ D.④⑤
难度: 中等查看答案及解析
-
实验报告中,以下数据合理的是( )
A.用碱式滴定管量取25.03mLH2SO4溶液
B.用托盘天平称取11.7gNaCl
C.用50mL量筒量取21.48mL稀硫酸
D.用pH试纸测定HNO3溶液的pH=3.7
难度: 简单查看答案及解析
-
用一种试剂鉴别乙醇、苯、1-己烯、苯酚溶液,可选用的试剂是( )
A.浓溴水 B.氯化铁溶液 C.盐酸 D.四氯化碳
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质
B.25℃时,用醋酸溶液滴定等浓度NaOH溶液至pH=7,v醋酸<vNaOH
C.向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成
D.AgCl易转化为AgI沉淀且K(AgX)=c(Ag+)·c(X-),故K(AgI)<K(AgCl)
难度: 中等查看答案及解析
-
某种碳酸饮料中主要含柠檬酸、碳酸、白砂糖、苯甲酸钠等成分,常温下测得其pH约为3.5,下列说法不正确的是( )
A.柠檬酸的电离会抑制碳酸的电离
B.该碳酸饮料中水的电离受到抑制
C.常温下,该碳酸饮料中Kw的值大于纯水中Kw的值
D.打开瓶盖冒出大量气泡,是因为压强减小,降低了CO2的溶解度
难度: 中等查看答案及解析
-
用滴定法测定Na2CO3(含NaCl杂质)的质量分数,下列操作会引起测定值偏高的是( )
A.试样中加入酚酞作指示剂,用标准酸液进行滴定
B.滴定管用蒸馏水洗涤后,直接注入标准酸液进行滴定
C.锥形瓶用蒸馏水洗涤后,直接加入待测溶液进行测定
D.滴定管用蒸馏水洗涤后,直接注入待测液,取20.00mL进行滴定
难度: 困难查看答案及解析
-
以下实验:①为检验RX是碘代烷,将RX与NaOH水溶液混合后再加入AgNO3溶液;②实验室里用无水乙醇和浓硫酸共热至140℃制乙烯;③用锌和稀硝酸反应制取氢气,用排水法收集氢气;④在试管中加入2mL10%的CuSO4溶液,滴入2%的NaOH溶液4~6滴,振荡后加入乙醛溶液0.5mL,加热至沸腾来检验醛基;⑤为检验淀粉已水解,将淀粉与少量稀硫酸加热一段时间后再加入银氨溶液,水浴加热。其中可能失败的实验是( )
A.①②③④⑤ B.①④⑤ C.③④⑤ D.③⑤
难度: 中等查看答案及解析
-
下列关于
的说法中正确的是( )
A.所有碳原子都在同一平面上
B.最多只可能有9个碳原子在同一平面上
C.只可能有5个碳原子在同一直线上
D.可能有6个碳原子在同一直线上
难度: 中等查看答案及解析
-
常温下,下列各组离子在制定溶液中一定能大量共存的是( )
①
的溶液:CO32-、Na+、AlO2-、NO3-
②无色溶液中:K+、Na+、MnO4-、SO42-
③加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+
④能使甲基橙试液显红色的溶液中:Na+、NH4+、I-、NO3-
⑤由水电离出的c(OH-)=1×10-13mol/L的溶液中:Na+、Ba2+、Cl-、Br-
A.②④ B.①③ C.①⑤ D.③⑤
难度: 困难查看答案及解析
-
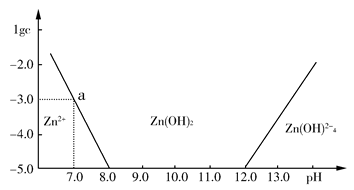
室温下向10mL0.1mol/LNaOH溶液中加入0.1mol/L的一元酸HA溶液pH的变化曲线如图所示。下列说法正确的是( )

A.a点所示溶液中c(Na+)>c(A—)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,c(Na+)=c(A—)+c(HA)
D.b点所示溶液中c(A—)>c(HA)
难度: 困难查看答案及解析
-
已知硫酸铅难溶于水,也难溶于硝酸,却可溶于醋酸铵溶液形成无色溶液,其化学方程式是PbSO4+2CH3COONH4=Pb(CH3COO)2+(NH4)2SO4。当在醋酸铅溶液中通入H2S时,有黑色沉淀PbS生成,表示这个反应的有关离子方程式正确的是( )
A.Pb(CH3COO)2+H2S=PbS↓+2CH3COOH
B.Pb2++H2S=PbS↓+2H+
C.Pb2++2CH3COO-+H2S=PbS↓+2CH3COOH
D.Pb2++2CH3COO-+2H++S2-=PbS↓+2CH3COOH
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列说法正确的有几个( )
①2L0.5mol/LFeCl3溶液中所含的Fe3+离子的个数为NA
②82g Na218O2固体与足量CO2反应转移电子总数为NA
③标准状况下,11.2LCH3Cl中所含分子数为0.5NA
④15g甲基(-CH3)所含电子数为10NA
⑤1molC6H14分子中共价键总数为20NA
⑥28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA
⑦16.9g过氧化钡(BaO2)固体中阴、阳离子总数约为0.2NA
A.2 B.3 C.4 D.5
难度: 困难查看答案及解析
-
水的电离平衡曲线如图所示,下列说法错误的是( )

A.图中五点Kw间的关系:B>C>A=D=E
B.若从A点到D点,可采用:温度不变在水中加入少量的酸
C.若从A点到C点,可采用:温度不变在水中加入适量的NH4Cl固体
D.若处在B点时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性
难度: 困难查看答案及解析
-
下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
A.在0.1mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
B.在0.1mol•L-1Na2CO3溶液中:c(OH-)+c(H+)=c(HCO3-)+2c(H2CO3)
C.向0.2 mol•L-1NaHCO3溶液中加入等体积0.1mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
D.常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1mol•L-1]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-)
难度: 困难查看答案及解析
-
25℃时,有下列四种溶液:①0.1mol/L的CH3COOH溶液;②pH=13的NaOH溶液;③0.05mol/L的H2SO4溶液;④0.1mol/L的Na2CO3溶液。则下列有关说法中正确的是( )
A.溶液④显碱性,用离子方程式解释其原因可表示成:CO32-+2H2O
H2CO3+2OH-
B.在上述四种溶液中,pH由大到小的顺序为:②④①③
C.将该温度下amL的溶液②与bmL的溶液③混合,所得混合溶液的pH=7,则a:b=1:2
D.若将溶液④和Al2(SO4)3溶液混合,一定可观察到有白色胶状沉淀和无色气体生成
难度: 困难查看答案及解析
-
下列说法正确的是( )
A.已知X在一定条件下转化为Y,
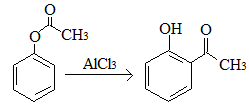 ,X与Y互为同分异构体,可用FeBr2溶液鉴别
,X与Y互为同分异构体,可用FeBr2溶液鉴别B.
能发生的反应类型有:加成反应、取代反应、消去反应、水解反应
C.淀粉、蛋白质最终的水解产物都只有一种
D.香柠檬粉具有抗氧化功能,结构为
它与溴水发生反应,1mol最多消耗3molBr2,它与NaOH溶液反应,1mol最多消耗2molNaOH
难度: 中等查看答案及解析