-
运用化学知识可以解决日常生活中遇到的许多问题,下列说法不正确的是
A.食用松花蛋时蘸些食醋可以去除氨味
B.用双氧水的稀溶液清洗伤口可以杀菌消毒
C.用淀粉溶液检验某食盐是否为加碘盐
D.长期使用含氟牙膏可预防龋齿
难度: 简单查看答案及解析
-
下列各组表达式意义相同的是
A.-NO2、NO2 B.-OH、
C.-COOH、HCOO- D.HCOOCH3、HOOCCH3
难度: 简单查看答案及解析
-
钢铁生锈过程的反应为:①2Fe+O2+2H2O→2Fe(OH)2 ②4Fe(OH)2+O2+2H2O→4Fe(OH)3 ③2Fe(OH)3→Fe2O3+3H2O,下列说法错误的是
A.上述反应均为氧化还原反应
B.反应①、②中氧化剂都是氧气
C.与铜质水龙头连接处的钢质水管易发生腐蚀
D.钢铁在潮湿的空气中通常发生吸氧腐蚀
难度: 简单查看答案及解析
-
下列说法不正确的是
A.蛋白质水解的最终产物是氨基酸
B.油脂水解生成甘油和高级脂肪酸或高级脂肪酸盐
C.淀粉水解的最终产物是葡萄糖
D.重油裂解可以得到汽油
难度: 简单查看答案及解析
-
下列实验环节错误的是
A.块状固体药品的取用:一横、二放、三慢竖
B.液体药品的倾倒:瓶塞倒放、紧挨瓶口、缓慢倒入
C.分液的操作:静置分层后将分液漏斗中下层液从下口放出,再将上层液从上口倒出
D.冷凝管的使用:冷却水下口进,上口出
难度: 简单查看答案及解析
-
化合物FeO具有NaCl型结构。在天然样品中,往往由于部分Fe2+被Fe3+代替,晶体存在缺陷,使n(Fe)︰n(O)<1。用Fe2+和Fe3+可以将组成为Fe0.95O的某天然FeO样品表示为
A.Fe2+0.45Fe3+0.50O B.Fe2+0.85Fe 3+0.10O
C.Fe2+0.15Fe3+0.80O D.Fe2+0.20Fe 3+0.75º
难度: 简单查看答案及解析
-
下列物质分类的正确组合是
分类
组合
碱
酸
盐
碱性氧化物
酸性氧化物
A
纯 碱
乙二酸
胆矾
氧化铝
二氧化碳
B
烧 碱
石炭酸
小苏打
氧化镁
一氧化碳
C
苛性钾
硬脂酸
萤石
过氧化钠
二氧化硫
D
苛性钠
油酸
苏打
氧化钠
三氧化硫
难度: 简单查看答案及解析
-
如右图所示,a、b是两根石墨棒,下列叙述错误的是
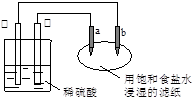
A.往滤纸上滴加酚酞试液,a极附近颜色变红
B.锌电极上的反应:Zn-2e→Zn2+
C.稀硫酸中硫酸根离子的物质的量不变
D.a是阳极,发生氧化反应
难度: 简单查看答案及解析
-
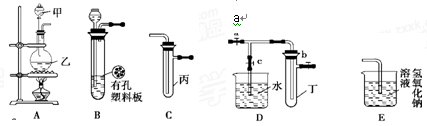
下列各图所示的实验原理、方法、装置和操作正确的是

难度: 简单查看答案及解析
-
已知C3N4 晶体具有比金刚石还大的硬度,且原子间均以单键结合。下列关于C3N4 晶体的说法正确的是
A.C3N4 晶体是分子晶体
B.C3N4 晶体中微粒间通过离子键结合
C.C3N4 晶体中C-N键的键长比金刚石中C-C键的键长要长
D.C3N4 晶体中每个C原子连接4个N 原子,而每个N原子连接3个C原子
难度: 简单查看答案及解析
-
下列各组顺序的排列不正确的是
A.离子半径:F->Mg2+>Al3+ B.热稳定性:HCl>H2S>AsH3
C.酸性:H3AlO3<H2CO3<H3PO4 D.水溶性:SO2< H2S< NH3
难度: 简单查看答案及解析
-
由一种阳离子与两种酸根离子组成的盐称为混盐。混盐CaOCl2在酸性条件下可以产生Cl2,下列关于混盐CaOCl2 的有关判断不正确的是
A.该混盐的水溶液呈碱性
B.该混盐具有较强的氧化性
C.该混盐中氯元素的化合价为零
D.该混盐与硫酸反应产生71gCl2时转移1mol 电子
难度: 简单查看答案及解析
-
实验室有一瓶久置的白色粉末,元素分析证明它由钾、硫、氧三种元素组成,钾和硫的质量比为39∶16,下列结论正确的是
A.根据元素分析结果推测该粉末为纯净物
B.将粉末溶于水,加入氯化钡,观察到有白色沉淀生成,证明原粉末是硫酸钾
C.将粉末加入盐酸中,产生气泡,证明原粉末是亚硫酸钾
D.将粉末溶于水,加入氯化钡和盐酸,观察到有白色沉淀和气泡生成,原粉末可能是硫酸钾和亚硫酸钾的混合物
难度: 简单查看答案及解析
-
如图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,该集气瓶中的气体可能是
① CO、O2 ② Cl2、CH4 ③ NO2、O2 ④ N2、H2
A.①② B.②③ C.②④ D.③④
难度: 简单查看答案及解析
-
将石墨置于熔融的钾中,石墨会吸收钾而形成称为钾石墨的物质,其组成是C8K、C24K、C36K、C48K和C60K。在钾石墨中,钾元素处于石墨中间层,因而石墨层之间被胀大,层间距离增大,钾原子把最外层电子交给石墨层但在遇到与金属钾易反应的其它物质时还会收回。下列对钾石墨的叙述正确的是
A.钾石墨是一类共价化合物 B.钾石墨导电性比石墨强
C.钾石墨遇水不产生氢气 D.C8K、C24K和C36K属于同素异形体
难度: 简单查看答案及解析
-
2008年诺贝尔化学奖授予美籍华裔钱永健等三位科学家,以表彰他们发现和研究了绿色荧光蛋白。荧光素是发光物质的基质,5-羧基荧光素(5-FAM)结构简式如右图所示,在碱性条件下有强烈的绿色荧光,广泛应用于荧光分析等。下列有关5-FAM说法不正确的是

A.可与碳酸氢钠溶液反应
B.分子式为C21H12O7
C.1mol 该物质与足量NaOH溶液反应,可消耗4 mol氢氧化钠
D.不与FeCl3发生反应
难度: 简单查看答案及解析
-
用下图装置测定水中氢、氧元素的质量比,方法是分别测定通氢气前后玻璃管的质量差和U型管的质量差,实验测得m(H)∶m(O)>1∶8。下列对导致这一结果的原因的分析中,不正确的是
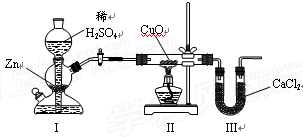
A.Ⅰ、Ⅱ装置之间缺少干燥装置 B.Ⅱ装置中玻璃管内有水冷凝
C.Ⅱ装置中CuO没有全部被还原 D.Ⅲ装置后缺少干燥装置
难度: 简单查看答案及解析
-
加入铝粉能放出H2的溶液中肯定不能大量共存的离子组是
A. Fe3+、NO、Cl-、NH B.Ba2+、Mg2+、NO、Cl-
C.SO
、Cl-、K+、NH D.SO
、K+、AlO、Na+
难度: 简单查看答案及解析
-
用NA为阿伏加德罗常数的值,下列叙述中正确的是
A.25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.1NA
B.标准状况下,2.24L乙烷含有的化学键总数为0.8NA
C.常温下,23gNO2和N2O4的混合气体中含有的氮原子数为0.5 NA
D.标准状况下,22.4L甲醇中含有的氧原子数为NA
难度: 简单查看答案及解析
-
下列反应的离子方程式正确的是
A.硫化亚铁中加入稀硫酸 2H++S2-→H2S↑
B.向苯酚钠溶液中通入少量的CO2
-O-+CO2+H2O→
-OH+HCO
C.向碳酸氢钠溶液中滴入少量石灰水 HCO+Ca2++OH-→CaCO3↓+H2O
D.向明矾溶液中加入过量的氨水 A13++3NH3·H2O→Al(OH)3↓+3NH
难度: 简单查看答案及解析
-
将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为
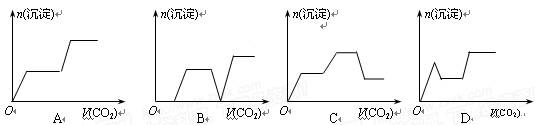
难度: 简单查看答案及解析
-
今有一混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH、Ba2+、Cl-、CO
、SO
。现取两份200mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体1.36g;②第二份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g。根据上述实验,以下推测正确的是
A.一定不存在Ba2+,NH可能存在 B.CO
一定存在
C.Na+一定存在 D.一定不存在Cl-
难度: 简单查看答案及解析