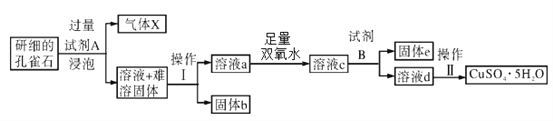
-
向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入稀盐酸,下列离子方程式与事实不相符的是
A. OH- + CO32-+ 2H+ = HCO3-+ H2O B. 2OH-+ CO32-+ 3H+ = HCO3-+2H2O
C. 2OH- + CO32- + 4H+ = CO2↑ + 3H2O D. OH- + CO32- + 3H+ = CO2↑ + 2H2O
难度: 中等查看答案及解析
-
下列物质在生活中应用时,发生氧化还原反应的是
A. 明矾作净水剂 B. 小苏打作食品蓬松剂
C. 硅胶作食品干燥剂 D. 铁粉作食品袋内的脱氧剂
难度: 简单查看答案及解析
-
下列所用材料不属于合金的是
A. 家用的铝窗 B. 建筑用的钢筋 C. 温度计用的水银 D. 铸造用的黄铜
难度: 简单查看答案及解析
-
下列试剂保存方法错误的是
A. 钠应保存在石蜡油或煤油中
B. 氢氟酸保存在玻璃瓶中
C. 保存FeSO4溶液时加入少量的铁粉
D. Na2CO3溶液保存在带橡皮塞的玻璃瓶中
难度: 简单查看答案及解析
-
下列与化学概念有关的说法错误的是
A. Na2O、MgO、CuO均为碱性氧化物
B. 水玻璃、双氧水均为混合物
C. 氨水能够导电,所以氨水是电解质
D. 钠与水反应既是氧化还原反应,也是放热反应
难度: 简单查看答案及解析
-
下列离子在溶液中能大量共存的是
A. Fe3+、 NH4+、SCN-、Cl- B. Na+、OH-、SiO32-、Cl-
C. Fe2+ 、H+、Na+ 、NO3- D. Na+、HCO3-、SO42-、OH-
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A. 明矾的净水原理:Al3+ + 3H2O = Al(OH)3↓ + 3H+
B. Na2O2溶于水:Na2O2 + H2O = 2Na+ + 2OH- + O2↑
C. 0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合:NH4+ + Al3+ +2SO42-+2Ba2+ +4OH-= 2BaSO4↓ + Al(OH)3↓ + NH3·H2O
D. 磁性氧化铁溶于足量的稀硝酸:Fe3O4+8H+ = Fe2+ + 2Fe3+ + 4H2O
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列判断正确的是
A. 0.1 mol Na2O2含有的离子总数为0.4NA
B. 常温常压下,18g H2O 所含的中子数为8NA
C. 5.6 g铁与足量盐酸反应转移的电子数为0.3NA
D. 将含0.l mol FeCl3的饱和溶液制成胶体后,生成的Fe(OH)3胶粒数目为0.1NA
难度: 简单查看答案及解析
-
下列各项操作中,会出现“先沉淀后溶解”现象的是
A. 向CaCl2溶液中通入CO2 直至过量
B. 向饱和的Na2CO3溶液中通入CO2直至过量
C. 向Na2SiO3溶液中逐滴加入盐酸直至过量
D. 向NaAlO2溶液中逐滴加入盐酸直至过量
难度: 简单查看答案及解析
-
下列各组物质中,不满足右图物质间转化关系(物质间的反应均为一步转化)的选项是


A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列除杂质的方法不正确的是
A. 铁粉中混有铝粉:加入过量NaOH溶液充分反应,过滤
B. FeCl2溶液中混有少量FeCl3:加入过量Cu粉 ,过滤
C. SiO2中混有Al2O3:加入过量盐酸充分反应,过滤
D. NaHCO3溶液中混有少量Na2CO3:往溶液中通入过量CO2气体
难度: 中等查看答案及解析
-
下列实验现象描述错误的是
编号
实验
现象
A
加热放在坩埚中的小块钠
钠先熔化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体
B
在酒精灯上加热用砂纸打磨过的铝箔
铝箔变软,失去光泽,熔化的铝并不滴落
C
在FeCl2溶液中滴入NaOH溶液
生成白色沉淀,沉淀很快变为灰绿色,最后变为红褐色
D
将水蒸气通过灼热的铁粉
黑色粉末变为红褐色
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
某无色溶液含有下列离子中的若干种:H+、NH4+、Fe3+、Ba2+、Al3+、CO32–、Cl–、OH–、NO3–。向该溶液中加入铝粉,只放出H2,则溶液中能大量存在的离子最多有
A. 3种 B. 4种 C. 5种 D. 6种
难度: 中等查看答案及解析
-
下列物质的检验,其结论正确的是
A. 用铁丝蘸取待测液在酒精灯火焰上灼烧,若火焰呈黄色,则表明待测液中含有Na+,不含K+
B. 向待测液里加入过量的硝酸无现象,再加入硝酸银溶液,若产生白色沉淀,则表明待测液中肯定含有Cl-
C. 向待测液里加入过量的盐酸,若产生能使澄清石灰水变浑浊的气体,则表明待测液中肯定含有CO32-
D. 向某溶液中先加氯水再加KSCN 溶液,溶液呈血红色,则表明原溶液中一定含Fe2+
难度: 中等查看答案及解析
-
配制250 mL 0.10 mol·L-1的NaOH溶液时,下列实验操作会使配得的溶液浓度偏大的是
A. 溶解后溶液尚未冷却就转移至容量瓶中
B. 转移溶液后未洗涤烧杯和玻璃棒
C. 在容量瓶中定容时仰视刻度线
D. 倒转摇匀后,发现液面低于刻度,再补水至刻度线
难度: 简单查看答案及解析
-
已知有如下反应:① 2BrO3-+Cl2 = Br2 + 2ClO3- ② ClO3-+ 5Cl- + 6H+ = 3Cl2+ 3H2O ③ 2FeCl2 + Cl2 = 2FeCl3 。根据上述反应,判断下列结论中错误的是
A. Cl2在反应②中既是氧化产物又是还原产物
B. Cl2在①、③反应中均作氧化剂
C. 氧化性强弱的顺序为:BrO3->ClO3-> Cl2 >Fe3+
D. 溶液中可发生:ClO3-+6Fe2++ 6H+ = Cl-+ 6Fe3+ + 3H2O
难度: 简单查看答案及解析
-
下列实验装置不能达到实验目的的是
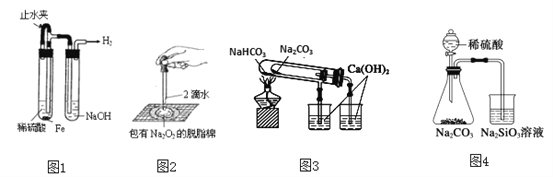
A. 图1:制备并观察氢氧化亚铁
B. 图2:证明过氧化钠与水反应放热
C. 图3:验证NaHCO3和Na2CO3的热稳定性
D. 图4:验证酸性强弱H2SO4>H2CO3>H2SiO3
难度: 简单查看答案及解析
-
硫代硫酸钠溶液与盐酸混合(Na2S2O3+ 2HCl ="=" 2NaCl + S↓+ SO2↑+ H2O),生成单质硫并沉淀出来。若将硫代硫酸钠溶液先与界面活性剂(不参与反应)均匀混合于烧杯中,再加入盐酸溶液并立刻搅拌,静置后无沉淀产生,得到含硫单质的胶体。下列叙述错误的是
A. 硫代硫酸钠与盐酸反应中,盐酸作还原剂
B. 烧杯中单质硫颗粒直径约为 10-9-10-7m
C. 界面活性剂减缓了硫生成的速率
D. 用平行光照射烧杯中液体,将观察到光的“通路”
难度: 中等查看答案及解析
-
相同质量的铁与足量的稀H2SO4及足量的CuO制单质铜,有人设计以下两种方案:
①Fe
H2
Cu,
②CuO
CuSO4
Cu。
若实验过程中,根据一般的实验方法和实验操作规则进行操作,则两者制得单质铜的量作比较正确的是( )
A. 相等 B. ①多 C. ②多 D. 无法判断
难度: 简单查看答案及解析
-
现有一块已知质量的铝镁合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案:
实验方案1:铝镁合金
测定生成的气体在标准状况下的体积
实验方案2:铝镁合金
测定生成的气体在标准状况下的体积
实验方案3:铝镁合金
溶液
过滤、洗涤、干燥后测定得到沉淀的质量
对能否测定出镁的质量分数的实验方案判断正确的是
A. 都能 B. 都不能
C. ①不能,其它都能 D. ②③不能,①能
难度: 中等查看答案及解析
-
在FeCl3和CuCl2的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示。则该溶液中FeCl3与CuCl2的物质的量浓度之比为

A. 3∶1 B. 1∶2 C. 2∶1 D. 1∶1
难度: 中等查看答案及解析