-
2012年2月,国务院同意发布新修订的《环境空气质量标准》增加了PM2.5监测指标。PM2.5是指大气中直径小于或等于2.5微米的可吸入肺颗粒物,对人体伤害很大。PM2.5来源广泛,下列不可能是PM2.5来源的是( )
A.风扬尘土 B.汽车尾气 C.餐饮油烟 D.水力发电
难度: 简单查看答案及解析
-
下列实验过程中,始终无明显现象的是( )
A.
通入
溶液中 B.
通入
溶液中
C.
通入
溶液中 D.
通入溴水中
难度: 简单查看答案及解析
-
将铜丝烧热,迅速插入氢气中,发生反应:
。若用下列物质代替氢气进行上述实验:①一氧化碳、②稀硝酸、③稀盐酸、④乙醇,铜丝表面所观察到的现象、铜丝质量变化情况与上述实验完全相同的是( )
A.①②③ B.①④ C.①③④ D.只有①
难度: 简单查看答案及解析
-
下列有关化学用语表达正确的是( )
A.Cl
的最外层电子排布式:
B.聚丙烯的结构简式:
CH2-CH2-CH2
C.CH2Br2只能表示一种物质
D.NH3的电子式:
难度: 简单查看答案及解析
-
下列溶液中能用来区别SO2和CO2气体的是( )
①澄清的石灰水 ②氯水 ③酸性高锰酸钾溶液 ④氯化钡溶液 ⑤品红溶液
A.①④⑤ B.②③⑤ C.①②③ D.②③④
难度: 简单查看答案及解析
-
根据以下三个热化学方程式:
2H2S(g)+3O2(g) → 2SO2(g)+2H2O(1)+akJ
2H2S(g)+O2(g) → 2S(s)+2H2O(1)+bkJ
2H2S(g)+O2(g) → 2S(s)+2H2O(g)+ckJ(a、b、c均为正数)
对a、b、c三者大小关系的判断正确的是( )
A.a>b>c B.a>c>b C.c>b>a D.b>a>c
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是( )
A.pH=1的溶液中:Fe
、NO
、SO
、Na
B.由水电离的c(H
)
mol/L的溶液中:Ca
、K
、Cl
、HCO
C.c(H
)/c(OH
)
的溶液中:NH
、Al
、NO
、Cl
D.c(Fe
)
mol/L的溶液中:K
、ClO
、SO
、SCN
难度: 简单查看答案及解析
-
双氧水可作为采矿业废液的处理剂,如用来消除采矿废液中的氰化物,反应方程式如下:KCN
H2O2
H2O → A
NH3↑。下列说法正确的是( )
A.生成物A是一种正盐 B.氨气是还原产物
C.该反应中H2O2作氧化剂 D.处理
mol KCN转移
mol电子
难度: 简单查看答案及解析
-
如图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体可能是( )
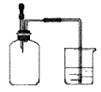
① CO、O2 ② Cl2、CH4 ③ NO2、O2 ④ N2、H2
A.①② B.②④ C.③④ D.②③
难度: 简单查看答案及解析
-
一定量的氢气在氯气中燃烧,所得混合物冷却后用500mL
mol·L
的NaOH溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为
mol,参加反应的氢气和所用氯气的物质的量之比为( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
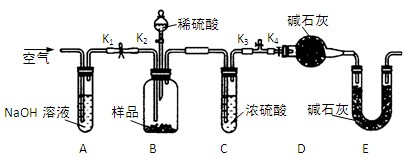
气体制备装置中不能“随开随制,随关随停”的是( )

难度: 简单查看答案及解析
-
已知25℃时,弱电解质的电离平衡常数:Ka(CH3COOH)
,Ka(HSCN)
。在物质的量浓度均为
mol·L
的CH3COONa和NaSCN混合溶液中,下列排序正确的是( )
A.c(OH
)>c(CH3COOH)>c(HSCN)>c(H
) B.c(OH
)>c(HSCN)>c(CH3COOH)>c(H
)
C.c(OH
)>c(SCN
)>c(CH3COO
)>c(H
) D.c(OH
)>c(CH3COO
)>c(SCN
)>c(H
)
难度: 简单查看答案及解析
-
氮化钠和氢化钠与水反应的化学方程式如下:Na3N
3H2O → 3NaOH + NH3↑,
NaH
H2O → NaOH
H2↑。有关Na3N和NaH的叙述正确的是( )]
A.离子半径:Na
N
H
B.加热熔化时,都只破坏离子键
C.与盐酸反应都只生成一种盐 D.与水反应都是氧化还原反应
难度: 简单查看答案及解析
-
紫罗兰酮是存在于玫瑰花、番茄等中的一种天然香料,它经多步反应可合成维生素A1
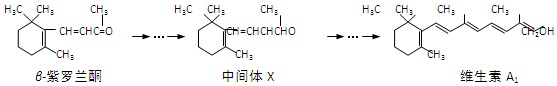
下列说法正确的是( )
A.
紫罗兰酮和中间体X都可使酸性KMnO4溶液褪色
B.
mol中间体X最多能与
mol H2发生加成反应
C.
紫罗兰酮分子式为:C13H22O
D.
紫罗兰酮与中间体X互为同分异构体
难度: 简单查看答案及解析
-
出土的锡青铜(铜锡合金)文物常有Cu2(OH)3Cl覆盖在其表面。下列说法错误的是( )
A.锡青铜的熔点比纯铜低
B.在自然环境中,锡青铜中的锡对铜起保护作用
C.锡青铜文物在潮湿环境中的腐蚀比干燥环境中快
D.生成Cu2(OH)3Cl覆盖物是电化学腐蚀过程,但不是化学反应过程
难度: 简单查看答案及解析
-
将amol钠和amol铝一同放入mg水(足量)中,所得溶液的密度为dg/mL,该溶液的质量百分比浓度为( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
如图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率,反应原理为:NO(g)
NO2(g)
2NH3(g)
2N2(g)
3H2O(g),相关说法正确的是 )

A.上述反应的正反应为吸热反应
B.催化剂①、②分别适合于250℃和450℃左右脱氮
C.曲线①、②最高点表示此时平衡转化率最高
D.相同条件下,改变压强对脱氮率没有影响
难度: 简单查看答案及解析
-
已知:
 ,如果要合成
,如果要合成所用的原始原料可以是( )
A.2-甲基-l, 3-丁二烯和2-丁炔 B.1, 3-戊二烯和2-丁炔
C.2, 3-二甲基-1, 3-戊二烯和乙炔 D.2, 3-二甲基-l, 3-丁二烯和丙炔
难度: 简单查看答案及解析
-
水是最宝贵的资源之一。下列表述正确的是( )
A.H2O的电子式为
B.4℃时,纯水的pH
C.D216O中,质量数之和是质子数之和的两倍
D.273K、101kPa,水分子间的平均距离d:d(气态)>d(液态)>d(固态)
难度: 简单查看答案及解析
-
常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
2Fe
H2O2
2H
→ 2Fe
2H2O 2Fe
H2O2 → 2Fe
O2↑
2H
下列说法正确的是( )
A.H2O2的氧化性比Fe
强,其还原性比Fe
弱
B.在H2O2分解过程中,溶液的pH逐渐下降
C.在H2O2分解过程中,Fe
和Fe
的总量保持不变
D.H2O2生产过程要严格避免混入Fe
难度: 简单查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A.将等物质的量的Ba(OH)2与明矾投入足量水中:
3Ba
6OH
2A1
3SO
→ 3BaSO4↓
2A1(OH)3↓
B.把Fe(OH)3溶于氢氟酸:Fe(OH)3
3H
→ Fe
3H2O
C.向H
O中投入Na2O2固体:2H
O
2Na2O2 → 4Na
4OH
18O2↑
D.在苯酚钠溶液中通入少量的二氧化碳气体:C6H5O
CO2
H2O → C6H5OH
HCO
难度: 简单查看答案及解析
-
合金(仅含铜、铁)中铜和铁的物质的量之和为y mol,其中Cu的物质的量分数为a,将其全部投入
mL bmol·L
的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是( )
A.若金属有剩余,在溶液中再滴入硫酸后,剩余金属一定又开始溶解
B.若金属全部溶解,则溶液中一定含有Fe
C.若金属全部溶解,且产生
mL气体(标准状况),则b
D.当溶液中金属离子只有Fe
、Cu
时,则a与b的关系为:b≥
(1
a/3)
难度: 简单查看答案及解析