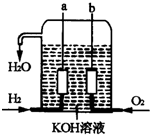
-
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的( )
①NaOH固体 ②H2O ③NH4Cl固体 ④CH3COONa固体 ⑤NaNO3固体 ⑥KCl溶液.
A.②④⑥
B.①②
C.②③⑤
D.②④⑤⑥难度: 中等查看答案及解析
-
下列关于化学反应的自发性叙述中正确的是( )
A.焓变小于0而熵变大于0的反应肯定是自发的
B.焓变和熵变都小于0的反应肯定是自发的
C.焓变和熵变都大于0的反应肯定是自发的
D.熵变小于0而焓变大于0的反应肯定是自发的难度: 中等查看答案及解析
-
“摇摇冰”是一种即用即饮的饮料.吸食时,将饮料罐隔离层中的化学物质和水混合后摇动即会制冷.该化学物质是( )
A.氯化钠
B.固体硝酸铵
C.生石灰
D.蔗糖难度: 中等查看答案及解析
-
下列说法正确的是( )
A.可逆反应的特征是正反应速率和逆反应速率相等
B.在其他条件不变时,使用催化剂只能改变反应速率,而不能改变化学平衡状态
C.在其他条件不变时,升高温度可以使平衡向放热反应方向移动
D.在其他条件不变时,增大压强一定会破坏气体反应的平衡状态难度: 中等查看答案及解析
-
已知空气-锌电池的电极反应为:锌片:Zn+20H--2e-=ZnO+H20,石墨:02+2H20+4e-=40H-.根据此判断,锌片是( )
A.负极,并被氧化
B.负极,并被还原
C.正极,并被氧化
D.正极,并被还原难度: 中等查看答案及解析
-
含NaOH 20.0g的稀溶液与足量的稀盐酸反应,放出28.7kJ的热量,表示该反应的热化学方程式是( )
A.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=+28.7kJ/mol
B.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=-28.7kJ/mol
C.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=+57.4kJ/mol
D.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=-57.4kJ/mol难度: 中等查看答案及解析
-
下列有关叙述正确的是( )
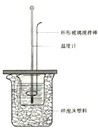
A.如所示,测定中和热时,大小两烧杯间填满碎纸的作用只是固定小烧杯
B.若用50mL 0.55mo1•L-1的氢氧化钠溶液,分别与50mL 0.50mo1•L-1的盐酸和50mL 0.25mo1•L-1的硫酸充分反应,两反应测定的中和热不相等
C.在中和滴定实验中,滴定管用蒸馏水洗涤后,再用标准液润洗,再加进标准液
D.进行中和滴定操作时,左手震荡锥形瓶,右手转动活塞控制液滴流速,眼睛要始终注视滴定管内溶液液面的变化难度: 中等查看答案及解析
-
已知两个热化学方程式:C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol;2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol
现有0.2mol炭粉和H2组成悬浮气,使其在O2中完全燃烧,共放出63.53kJ的热量,则炭粉与H2的物质的量之比是( )
A.1:1
B.1:2
C.2:3
D.3:2难度: 中等查看答案及解析
-
铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法正确的是( )
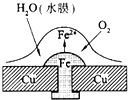
A.正极电极反应式为:2H++2e-=H2↑
B.此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C.此过程中Fe、Cu均被腐蚀
D.此过程中电流从Fe移向Cu难度: 中等查看答案及解析
-
某同学欲完成2HCl+2Ag═2AgCl↓+H2↑反应,设计了下列四个实验,你认为可行的实验是( )
A.
B.
C.
D.难度: 中等查看答案及解析
-
已知NaHSO4在水中的电离方程式为:NaHSO4═Na++H++SO42-.某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2.下列对该溶液的叙述中,不正确的是( )
A.该温度高于25℃
B.由水电离出来的H+的浓度是1.0×10-10mol/L
C.加入NaHSO4晶体抑制了水的电离
D.该温度下加入等体积pH=12的NaOH溶液可使该溶液恰好呈中性难度: 中等查看答案及解析
-
下列各组离于在溶液中既可以大量共存,且加入氨水后也不产生沉淀的是( )
A.Na+Ba2+Cl-SO42-
B.K+AlO2-NO3-OH-
C.H+NH4+Al3+SO42-
D.H+Cl-CH3COO-NO3-难度: 中等查看答案及解析
-
用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是( )
A.
B.
C.c(H+)和c(OH-)的乘积
D.OH-的物质的量难度: 中等查看答案及解析
-
氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是( )
A.1mol/L氢氰酸溶液的pH约为3
B.HCN易溶于水
C.10mL 1mol/L HCN恰好与10mL 1mol/L NaOH溶液完全反应
D.HCN溶液的导电性比强酸溶液的弱难度: 中等查看答案及解析
-
1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,是该碱溶液的pH等于( )
A.9.0
B.9.5
C.10.5
D.11.0难度: 中等查看答案及解析
-
可逆反应4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g),若反应速率分别用
表示,则关系正确的是( )
A.v(NH3)=v(H2O)
B.v(NH3)=v(H2O)
C.v(NH3)=v(O2)
D.v(NH3)=v(NO)
难度: 中等查看答案及解析
-
在a、b两个相同的容器中,分别加入相同量的A和B,发生可逆反应:A(g)+3B(g)⇌2C(g)(正反应为放热反应),两容器中C的体积分数与时间的关系如图所示,则a、b两线不同的可能原因是( )

A.a的温度高于b
B.a使用了催化剂,而b未用
C.a的压强大于b
D.a的温度低于b难度: 中等查看答案及解析
-
将足量的BaCO3粉末分别加入下列溶液中,充分溶解至溶液饱和.各溶液中Ba2+的浓度最小的为( )
A.10 mL 0.2 mol/LNa2CO3溶液
B.40 mL水
C.50 mL 0.01 mol/L 氯化钡溶液
D.100 mL 0.01 mol/L盐酸难度: 中等查看答案及解析
-
已知0.02mol•L-1CH3COOH溶液和0.01mol•L-1NaOH溶液以等体积混和后溶液呈酸性,则该混合液中微粒浓度关系正确的( )
A.c (CH3COO-)>c (Na+)
B.c (Na+)+c (H+)=c (OH-)+c (CH3COOH)+c (CH3COO-)
C.c (CH3COOH)>c (CH3COO-)
D.c (CH3COOH)+c (CH3COO-)=0.02 mol•L-1难度: 中等查看答案及解析
-
在一定温度下,一定体积的密闭容器中有如下平衡:H2(g)+I2(g)⇌2HI(g).已知H2和I2的起始浓度均为0.10mol•L-1时,达平衡时HI的浓度为0.16mol•L-1.若H2和I2的起始浓度均变为0.20mol•L-1,则平衡时H2的浓度是( )
A.0.16
B.0.08
C.0.04
D.0.02难度: 中等查看答案及解析