-
下列实验操作中:①过滤;②蒸发;③溶解;④取液体试剂;⑤取固体试剂.一定要用到玻璃棒的是( )
A.①②③
B.④⑤
C.①④
D.①③⑤难度: 中等查看答案及解析
-
用如图表示的一些物质或概念间的从属关系中正确的是( )
X Y Z A 液氯 非电解质 纯净物 B 电解质 盐 化合物 C 胶体 分散系 混合物 D 酸性氧化物 非金属氧化物 氧化物 
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
以下化学用语正确的是( )
A.作为相对原子质量测定标准的碳核素:
B.NaCl的电子式:
C.氯离子的结构示意图:
D.甲烷的分子式为:H4C难度: 中等查看答案及解析
-
现代社会,人们越来越关注饮食中的营养成分.海苔、海带等许多海产品中含有丰富的碘,这里的碘应理解为( )
A.单质
B.分子
C.元素
D.同位素难度: 中等查看答案及解析
-
下列物质的转化中,只有加入酸才能一步实现的是( )
A.Fe→FeSO4
B.Cu(OH)2→CuCl2
C.CaO→CaSO4
D.CaCO3→CO2难度: 中等查看答案及解析
-
在盛有溴水的三支试管中分别加入苯、四氯化碳和酒精,振荡后静置,出现如图所示现象,则加入的试剂分别是( )
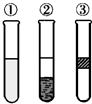
A.①是酒精,②是CCl4,③是苯
B.①是苯,②是CCl4,③是酒精
C.①是CCl4,②是苯,③是酒精
D.①是苯,②是酒精,③是CCl4难度: 中等查看答案及解析
-
放射性同位素
可于治疗肿瘤,该同位素的原子核内的中子数与核外电子数之差是( )
A.72
B.19
C.52
D.125难度: 中等查看答案及解析
-
下列各种仪器,常用于物质分离的是( )

A.①③⑦
B.②③⑥
C.①④⑦
D.③④⑦难度: 中等查看答案及解析
-
下列过程中发生化学变化的是( )
A.用四氯化碳萃取溴水中的溴
B.用蒸馏的方法制取蒸馏水
C.用过滤的方法除食盐水中的泥沙
D.氯水使石蕊先变红后褪色难度: 中等查看答案及解析
-
已知某溶液中可能含有K+、Ba2+、
、I-.分别取样:
①用pH计测试,溶液显酸性;
②加氯水和淀粉溶液无明显现象.
为确定该溶液的组成,还需检验的离子是( )
A.Ba2+
B.K+
C.I-
D.难度: 中等查看答案及解析
-
实验是研究化学的基础,图中所示的实验方法、装置或操作完全正确的是( )
A.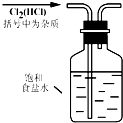
除去混有的杂质气体
B.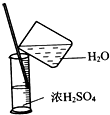
浓硫酸稀释
C.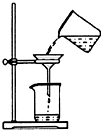
分离出AgNO3溶液中的AgCl
D.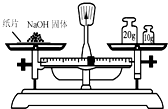
称量30.46g的NaOH固体难度: 中等查看答案及解析
-
下列描述中正确的是( )
A.氯水是纯净物,氯水中的次氯酸具有杀菌消毒作用
B.加碘食盐中所加的“碘”一般是碘化钾
C.氢氧化铁胶体可以使混浊的水变澄清,可作水的消毒剂
D.漂白粉的有效成分是次氯酸钙难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.2mol H2O的质量为36g•mol-1
B.3.01×1023个SO2分子的质量为32g
C.NH3的摩尔质量为17g
D.标况下,1 mol任何物质体积约为22.4L难度: 中等查看答案及解析
-
鉴别FeCl3溶液和Fe(OH)3胶体,下列方法中最简单有效的是( )
A.加入足量的盐酸
B.加热煮沸
C.加入足量的NaOH溶液
D.观察能否产生丁达尔现象难度: 中等查看答案及解析
-
下列反应中氯元素全部被还原的是( )
A.MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑
B.Cl2+2NaOH=NaCl+NaClO+H2O
C.5Cl2+I2+6H2O=10HCl+2HIO3
D.Cu(OH)2+2HCl═CuCl2+2 H2O难度: 中等查看答案及解析
-
下列除去杂质的方法错误的是( )
待提纯物质 杂质 试剂 主要操作 A I2 KI、H2O 乙醇 萃取 B Cl2 H2O 浓硫酸 洗气 C NaCl KNO3 H2O 蒸发结晶 D Cu Fe、Zn 稀硫酸 过滤
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )

A.NaCl固体是非电解质
B.NaCl在水中能电离出可以自由移动的离子
C.NaCl能使溶液中的水电离出大量的离子
D.NaCl溶液是电解质
E.NaCl溶液是难度: 中等查看答案及解析
-
已知在热的碱性溶液中,NaClO发生如下反应:3NaClO═2NaCl+NaClO3.在相同条件下NaClO2在热的碱性溶液中也能发生类似的反应,其最终产物是( )
A.NaCl、NaClO3
B.NaClO3、NaClO4
C.NaCl、NaClO
D.NaClO、NaClO3难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数,下列叙述正确的是( )
A.常温常压下,48 g O2和48 g O3含有的氧原子数均为3NA
B.1 mol•L-1NaCl溶液中含有Cl-的个数为NA
C.等质量的N2和CO所含分子数均为NA
D.标准状况下,22.4 L的水中含有NA个H2O分子难度: 中等查看答案及解析
-
许多元素有多种核素,现仅限以氧的两种核素
O、
O和氢的两种核素H、D组成水,最多可能有多少种水分子( )
A.3种
B.6种
C.9种
D.12种难度: 中等查看答案及解析
-
下列溶液中的Cl-浓度与100mL 1mol•L-1 MgCl2溶液中的Cl-浓度相等的是( )
A.200 mL 1 mol•L-1 KCl溶液
B.50 mL 1mol•L-1CaCl2溶液
C.150 mL 2 mol•L-1 NaCl溶液
D.50mL 1 mol•L-1AlCl3溶液难度: 中等查看答案及解析
-
氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等.下列反应与Br2+SO2+2H2O═H2SO4+2HBr相比较,水的作用不同的是( )
A.2F2+2H2O═4HF+O2
B.Cl2+H2O═HCl+HClO
C.2Na2O2+2H2O═4NaOH+O2↑
D.4Fe(OH)2+O2+2H2O═4Fe(OH)3难度: 中等查看答案及解析
-
在一定温度和压强下的理想气体,影响其所占体积大小的主要因素是( )
A.分子直径的大小
B.分子间距离的大小
C.分子间引力的大小
D.分子数目的多少难度: 中等查看答案及解析
-
下列实验操作中正确的是( )
A.提取碘水中的碘:加入适量乙醇,振荡、静置、分液
B.蒸馏时,冷却水应从冷凝管的下口通入,上口流出
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.提纯混有少量硝酸钾的氯化钾:先将样品溶于热水,制得饱和,再冷却、结晶并过滤难度: 中等查看答案及解析

