-
下列物质中不能作漂白剂的是
A .SO2 B.Ca(ClO)2 C .浓硫酸 D .Na2O2
难度: 简单查看答案及解析
-
“纳米技术”广泛的应用于催化及军事科学中,“纳米技术”是指粒子直径在几纳米到几十米的材料.如将“纳米材料”分散到液体分散剂中,所得的混合物具有的性质是
A.能全部通过半透膜 B.能发生丁达尔现象
C.一定能导电 D.一定为悬浊液或乳浊液
难度: 简单查看答案及解析
-
下列表格中各项都正确的一组是
类别选项
碱
盐
电解质
非电解质
A
明矾
食盐
石墨
醋酸
B
纯碱
CaCO3
NH3•H2O
Fe
C
烧碱
小苏打
BaSO4
干冰
D
KOH
CuSO4
Na2SO4
NaClO
难度: 简单查看答案及解析
-
下列有关氮及其化合物的说法不正确的是
A.硝酸应保存在棕色试剂瓶中
B.铵态氮肥不宜与碱性废料混合使用
C.常温下铁、铝不与浓硝酸反应
D.NO可用排水法收集,NO2可用向上排空气法收集
难度: 简单查看答案及解析
-
下列关于Cl、N、S等非金属元素单质及其化合物的说法错误的是
A.漂白粉的成分是次氯酸钙和氯化钙
B.实验室可用NaOH溶液处理SO2、NO2
C.将浓氨水滴到氢氧化钠固体中可以制取氨气
D.CO2、NO2、SO2都能与H2O反应,其反应原理相同
难度: 中等查看答案及解析
-
将足量CO2气体通入水玻璃(Na2SiO3溶液)中,然后加热蒸干,再在高温下充分灼烧,最后所得的固体物质是
A.SiO2 B.Na2CO3、Na2SiO3
C.Na2CO3、SiO2 D.Na2SiO3
难度: 简单查看答案及解析
-
I2Cl6体在常温下就会“升华”,蒸气冷却可得到晶体ICl3。ICl3遇水会产生大量的腐蚀性白色烟雾,有强烈的催泪性。若生成物之一是HCl,则另一种是
A.HIO2 B.HIO2 C.HIO3 D.ICl
难度: 中等查看答案及解析
-
下列有关海水资源综合利用的说法错误的是
A.从海水中可以得到NaCl电解熔融NaCl可制备金属钠
B.海水蒸发制海盐的过程中不涉及化学变化
C.从海水中提溴、碘、镁单质,都利用了氧化还原反应
D.利用潮汐发电是将化学能转化为电能
难度: 简单查看答案及解析
-
下列关于物质的用途或说法不正确的是
A.氧化铝熔点很高,可用作耐火材料
B.铝热反应原理是炼铁最常用的反应原理
C.过氧化钠可以用作呼吸面具中的供氧剂
D.青铜是我国使用最早的合金
难度: 简单查看答案及解析
-
以下六种饱和溶液①Ba(NO3)2 ②Ca(OH)2 ③Na2SiO3 ④NaAlO2 ⑤Na2CO3 ⑥NH3和NaCl,分别持续通入CO2,最终得到沉淀或析出晶体的是
A.③④⑤⑥ B.②③④⑥ C.①③④⑥ D.②③④⑤
难度: 中等查看答案及解析
-
下列对有关化学反应过程或实验现象的解释中,正确的是
A.Cl2的水溶液可以导电,说明Cl2是电解质
B.在高温条件下,C能置换出SiO2中的Si,说明C的氧化性强于Si
C.向淀粉碘化钾的溶液中加入氯水,溶液变为蓝色,说明Cl2的氧化性强于I2
D.在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后,溶液褪色,说明BaCl2溶液有酸性
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数,下列叙述中错误的是
A.1mol金属钠与足量氧气反应转移的电子数为NA
B.标准状况下,22.4L甲苯中含C-H键数目为8NA
C.标准状况下,11.2L氦气中含有0.5NA个氦原子
D.常温常压下,含有NA个氮气和乙烯分子的混合气体质量为28g
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A.MgSO4溶液与Ba(OH)2溶液反应:SO42-+Ba2+=BaSO4↓
B.向澄清的石灰水中加入过量NaHCO3溶液:HCO3-+Ca2++OH-=CaCO3↓+H2O
C.向Al2(SO4)3溶液中加入过量氨水溶液:Al3+ +3NH3·H2O =Al(OH)3↓+3NH4+
D.向Ca(ClO)2溶液中通入SO2: Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
难度: 简单查看答案及解析
-
某溶液中含有的溶质是FeBr2、FeI2,若先向该溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,溶液变为红色,则下列叙述正确的是
①原溶液中的Br-一定被氧化;
②通入氯气之后原溶液中的Fe2+一定有部分或全部被氧化;
③不能确定通入氯气后的溶液中是否存在Fe2+;
④若取少量所得溶液,再加入CCl4溶液,静置、分液,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中的I-、Fe2+、Br-均被完全氧化
A.①③④ B.①②③ C.②③④ D.①②③④
难度: 中等查看答案及解析
-
下列关于甲、乙、丙、丁四种仪器装置的有关用法,其中不合理的是
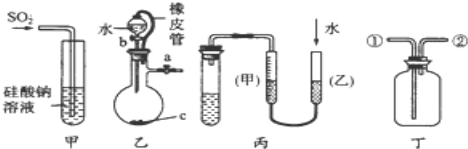
A.甲装置:可用来证明硫的非金属性比硅强
B.乙装置:橡皮管的作用是能使水顺利流下
C.丙装置:用图示的方法能检查此装置的气密性
D.丁装置:可在瓶中先装入某种液体收集NO气体
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得出的结论错误的是
选项
实验操作
实验现象
结论
A
SO2通入酸性高锰酸钾溶液
酸性高锰酸钾溶液褪色
SO2具有还原性
B
向NaSiO3溶液的试管中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去
2 min后,试管里出现凝胶
非金属性:Cl>Si
C
将盛有铜片的容器中加入浓硝酸
产生大量红棕色气体;溶液变为蓝绿色
浓硝酸具有强氧化性
D
浓硫酸滴到湿润的蔗糖中
蔗糖变成黑色海绵状
浓硫酸具有脱水性和强氧化性
难度: 中等查看答案及解析
-
下列反应中,不属于取代反应的是
A.苯与液溴在FeBr3催化作用下生成溴苯的反应
B.丙烯和氯气在一定条件下反应生成ClCH2CH=CH2
C.乙酸与乙醇生成乙酸乙酯的反应
D.乙烯与HCl气体反应生成一氯乙烷的反应
难度: 中等查看答案及解析
-
下列关于有机化合物的说法中,正确的是
A.CH3CH2=CHCOOH能发生加成、取代、氧化反应
B.油脂、淀粉、纤维素都属于天然高分子化合物
C.蛋白质溶液加入CuSO4溶液会析出,这一过程属于蛋白质的盐析
D.甲苯和乙烯都可与溴水发生化学反应使溴水褪色
难度: 中等查看答案及解析
-
下列说法正确的是
A.石油裂解可以得到氯乙烯
B.油脂水解可得到氨基酸和甘油
C.所有烷烃和蛋白质中都存在碳碳单键
D.淀粉和纤维素水解的最终产物都是葡萄糖
难度: 简单查看答案及解析
-
下列说法不正确的是
A.乙烯能使酸性高锰酸钾溶液褪色,是因为乙烯分子中含有碳碳双键
B.甲烷和乙烯都可以与氯气反应,且反应类型相同
C.用酸性重铬酸钾溶液检验酒驾,发生的反应属于乙醇的氧化反应
D.氨基酸分子中均含有羧基(-COOH)和氨基(-NH2)
难度: 中等查看答案及解析
-
烷基取代苯
可被酸性高锰酸钾溶液氧化为
(苯甲酸),但若烷基R中直接与苯环相连接的碳原子上没有C-H键,则不容易被氧化得到苯甲酸。据此判断,分子式为C11H16的一烷基取代苯,可以被氧化为苯甲酸的异构体共有
A.6种 B.7种 C.8种 D.9种
难度: 简单查看答案及解析
-
向某NaOH溶液中通入CO2气体后得到溶液M,因CO2通入的量不同,溶液M的组成也不同,若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如下图所示。则下列分析与判断正确的是(不计CO2的溶解)

A.若OB=0,则溶液M为Na2CO3溶液
B.若OB=BC,则形成溶液M所发生的离子反应方程式为:OH-+CO2=HCO3-
C.若3OB=BC,则溶液M中c(NaHCO3)=2c(Na2CO3)
D.若OB>BC,则溶液M中大量存在的阴离子为CO32-和HCO3-
难度: 简单查看答案及解析
-
agMg、Al合金完全溶解在C1 mol·L-1、V1L HCl溶液中,产生b g H2。再向反应后的溶液中加入C2 mol·L-1、V2 L NaOH溶液,恰好使沉淀达到最大值,且沉淀质量为d g。下列关系错误的是
A.C1=C2V2/V1
B.铝为 (24b-a)/9 mol
C.d=a+17b
D.与金属反应后剩余盐酸为(C1V1-b)mol
难度: 简单查看答案及解析
-
符合右图的反应是

x轴
y轴
A
向氯化铝溶液中加入氢氧化钠溶液
氢氧化钠的物质的量
生成沉淀的质量
B
向碳酸钠溶液中加入稀盐酸
盐酸的体积
产生气体的体积
C
向溴化亚铁溶液中通入氯气
氯气的体积
生成Br2的物质的量
D
向氢氧化钙溶液中通入二氧化碳
二氧化碳的体积
生成碳酸氢钙的质量
难度: 简单查看答案及解析
-
已知:将Cl2通入适量KOH溶液,产物中可能有KC1、KClO、KC1O3,且
的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是
A.若某温度下,反应后c(Cl-):c(ClO-)=11,则溶液中c(ClO-):c(ClO3-)=1/2
B.参加反应的氯气的物质的量等于1/2amol
C.改变温度,产物中KC1O的最大理论产量为1/2 amol
D.改变温度,产物中KC1O3的最大理论产量为1/7amol
难度: 简单查看答案及解析