-
我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其淸如水,味极浓烈,盖酒露也。”这里所用的“法”是指
A. 萃取 B. 渗析 C. 蒸馏 D. 过滤
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 5.6L氮气与足量镁粉充分反应后,转移的电子数为1.5NA
B. 常温下56 g铁片投入足量浓H2SO4中生成1.5NA个SO2分子
C. 常温下,22gCO2和N2O混合气体中,含有的原子数目为1.5NA
D. 6.4 g Cu与40 mL 10 mol·L-1浓硝酸作用能生成NO2的分子数为0.2NA
难度: 困难查看答案及解析
-
下列有关有机物的结构和性质的叙述中正确的是
A.
、
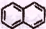 、
、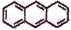 互为同系物
互为同系物B. 丙烯和苯分子内所有原子均在同一平面内
C. 乙烷、乙烯和聚乙烯均可使酸性高锰酸钾溶液褪色
D. 乙酸与乙醇可以发生酯化反应,又均可与金属钠发生置换反应
难度: 中等查看答案及解析
-
下表各组物质之间通过一步反应不可以实现如下图所示转化关系的是
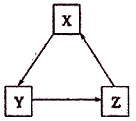
选项
X
Y
Z
A
A1
AlCl3
NaAlO2
B
NaCl
NaHCO3
Na2CO3
C
NO
NO2
HNO3
D
S
Cu2S
SO2
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
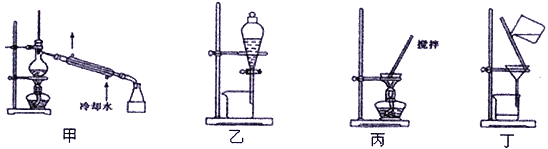
进行下列实验,相关说法正确的是
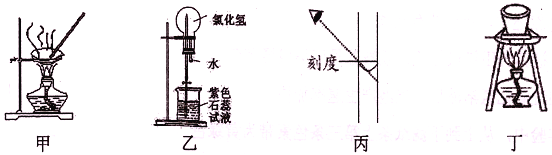
A. 图甲:蒸干NH4Cl饱和溶液制备NH4Cl晶体
B. 图乙:形成美丽的红色喷泉,证明HC1极易溶于水
C. 图丙:配制一定物质的量浓度的NaOH溶液,定容时如图则所配NaOH溶液浓度偏低
D. 图丁:所示装置用于除去碳酸氢钠固体中的少量碳酸钠
难度: 困难查看答案及解析
-
由下列实验及现象不能推出相应结论的是
选项
实验
现象
结论
A
用煮沸过的蒸馏水将Na2SO3固体样品溶解,加入足量稀盐酸酸化,再加入氯化钡溶液
有白色沉淀产生
Na2SO3样品己变质
B
向硅酸钠溶液中滴加1滴酚酞溶液,然后逐滴加入稀盐酸至红色变浅并接近消失时停止
试管里出现凝胶
非金属性:Cl>Si
C
向盛有浓氨水的锥形瓶中通入氧气, 并将灼热的铂丝置于液面上方
铂丝保持红热,且瓶内有白烟产生
氨水易挥发
D
将金属钠放入燃烧匙中,点燃,迅速伸入集满SO2的集气瓶
产生大量黄色的烟,且瓶内有白色颗粒生成
SO2具有氧化性
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
某白色粉末由两种物质组成,取少量样品加入适量水中有少量气泡并有少量不溶物,再向其中加入足量盐酸,固体不溶解;将上述悬浊液过滤,滤渣中加入浓硝酸并加热,固体全部溶解。则可推得该白色粉末可能为
A. Na2S2O3、NaHSO4 B. NaHCO3、KAl(SO4)2·12H2O
C. Na2SiO3、NH4Cl D. (NH4)2SO4、Ba(OH)2
难度: 简单查看答案及解析
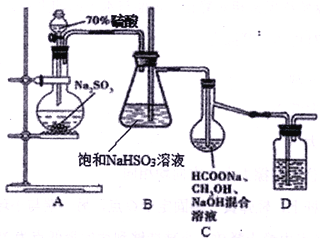
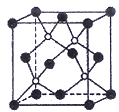
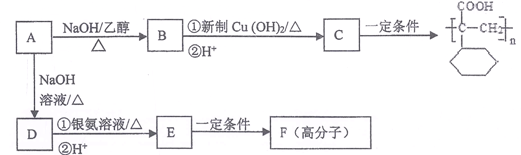
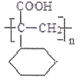 平均分子量为15000,则平均聚合度约为____________________ (填编号)。
平均分子量为15000,则平均聚合度约为____________________ (填编号)。