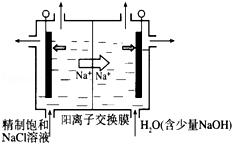
-
民以食为天,下列关于厨房调味品的说法正确的是
A.食醋和料酒的主要成分都是有机酸
B.食盐和味精的成分中都含有钠离子
C.食用油和人造奶油都是油酸甘油酯
D.蔗糖和石碱都是可溶于水的电解质
难度: 简单查看答案及解析
-
下列有关化学用语描述正确的是
A.乙醇的分子式C2H5OH
B.硫离子的结构示意图:
C.NH4Cl的电子式:
D.对氯甲苯的结构简式:
难度: 中等查看答案及解析
-
下列化学试剂的保存不正确的是
A.金属钠保存在煤油中
B.白磷保存在水中
C.NaOH固体密封存放于塑料瓶中
D.浓硝酸存放于棕色广口瓶中
难度: 简单查看答案及解析
-
针对如图装置的说法中,正确是
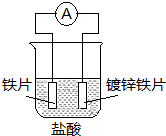
A.溶液中pH值明显下降
B.阴极的电极反应式:Fe﹣2e→Fe2+
C.铁片为正极,镀锌铁片为负极
D.电子由锌经溶液流向铁
难度: 中等查看答案及解析
-
玻璃棒是化学实验中常用的仪器,通常用于搅拌、引流等.下列有关实验过程中,不需要使用玻璃棒进行操作的是
A.用pH试纸测定Na2CO3溶液的pH
B.从食盐水中提取NaCl
C.用新制的FeSO4溶液和NaOH溶液制备Fe(OH)2
D.配制100ml 0.1000mol/L的NaCl溶液
难度: 中等查看答案及解析
-
根据碘与氢气反应的热化学方程式下列判断正确的是
(i) I2(g)+H2(g) 2HI(g)△H=﹣9.48kJ/mol
(ii) I2(S)+H2(g)2HI(g)△H=+26.48kJ.
A.1 mol I2(g)中通入2gH2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应(i)的产物比反应(ii)的产物稳定
D.反应(ii)的反应物总能量比反应(i)的反应物总能量低
难度: 简单查看答案及解析
-
下列有关物质的性质与应用不相对应的是
A.SO2具有氧化性,可用于漂白纸浆
B.FeCl3溶液能与Cu反应,可用于蚀刻印刷电路
C.明矾能水解生成Al(OH)3胶体,可用作净水剂
D.Zn具有还原性和导电性,可用作锌锰干电池的负极材料
难度: 简单查看答案及解析
-
室温下,对于0.10mol•L﹣1的氨水,下列判断正确的是
A.用相同浓度的HNO3溶液中和,硝酸体积小于氨水时,溶液可能呈中性
B.温度不变,加水稀释后溶液中c(NH4+)•c(OH﹣)不变
C.加水稀释后,溶液中导电粒子的数目减少
D.其溶液的pH=13
难度: 简单查看答案及解析
-
下列实验过程中,始终无明显现象的是
A.Cl2通入Na2CO3溶液中
B.CO2通入CaCl2溶液中
C.NH3通入AgNO3溶液中
D.SO2通入NaHS溶液中
难度: 简单查看答案及解析
-
“酸化”是实验中经常采用的方法,下列说法正确的是
A.提高高锰酸钾的氧化能力,用浓盐酸酸化
B.抑制Fe2+ 的水解,用稀硝酸酸化
C.检验某卤代烃中是否含氯元素,先加HNO3酸化,再加AgNO3溶液检验.
D.确认溶液中含有SO42﹣ 时,先用过量盐酸酸化,再加BaCl2溶液检验.
难度: 简单查看答案及解析
-
BHT是一种常用的食品抗氧化剂,从
出发合成BHT的方法有如图两种.下列说法错误的是
(BHT)
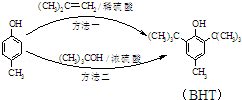
A.BHT与
都能使酸性KMnO4褪色
B.BHT在水中的溶解度小于苯酚
C.两种方法的反应类型都是加成反应
D.从绿色化学角度分析方法一优于方法二
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.硫化亚铁溶于足量稀硝酸中:FeS+2H+═Fe2++H2S↑
B.石灰石溶于醋酸:CaCO3+2CH3COOH═2CH3COO﹣+Ca2++CO2↑+H2O
C.FeCl2溶液中通入少量氯气:Fe2++Cl2═Fe3++2Cl﹣
D.硫酸亚铁溶液中滴加酸化的双氧水:2Fe2++2H++H2O2═2Fe3++2H2O
难度: 中等查看答案及解析
-
下列化合物中,核磁共振氢谱只出现两组峰且峰面积之比为3:1的是
A.对二甲苯 B.2﹣丙醇 C.2﹣甲基丙烯 D.均三甲苯
难度: 简单查看答案及解析
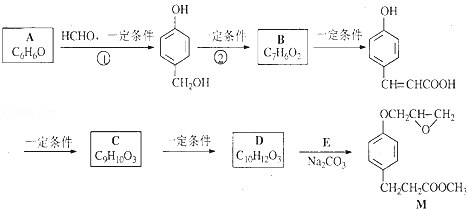
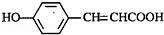 的邻位异构体分子内脱水的反应方程式
的邻位异构体分子内脱水的反应方程式