-
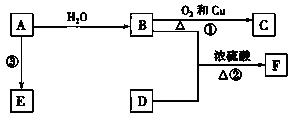
(14分)工业上从海水中提取溴的方法如下:
①将蒸馏(制淡水)后浓缩的海水用硫酸进行酸化;
②向酸化的海水中通入足量氯气,使溴离子转化为溴单质;
③向上述溶液中通入空气和水蒸气,将溴单质吹入盛有二氧化硫水溶液的吸收塔内转化成氢溴酸;
④向吸收塔内通入适量的氯气;
⑤用四氯化碳萃取吸收塔中的溴单质。
请完成下列问题:
(1)在实验室中蒸馏海水制淡水时,常用的仪器除了酒精灯、锥形瓶、牛角管、冷凝管、石棉网及必要的夹持仪器,还需要的玻璃仪器有 ;蒸馏时碎瓷片的作用是______________________
(2)步骤②中反应的离子方程式为 。
(3)步骤③的目的是使溴单质富集,试写出溴单质与二氧化硫水溶液反应的化学方程式 。
反应中________(写化学式)是氧化剂。1mol氧化剂在反应中得到_______mol电子。
(4)下列能代替四氯化碳来萃取溴的试剂是 _________(填序号)
A.盐酸 B.酒精 C.乙酸 D.苯
难度: 中等查看答案及解析
-
(12分)实验室制取乙酸乙酯的主要步骤如下:
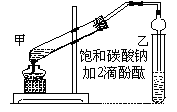
①在甲试管(如图)中加入2mL浓硫酸、3mL乙醇和2mL乙酸的混合溶液.
②按如图连接好装置(装置气密性良好)并加入混合液,用小火均匀地加热3~5min。
③待试管乙收集到一定量产物后停止加热,撤出试管并用力振荡,然后静置待分层。
④分离出乙酸乙酯层、洗涤、干燥。
(1)反应中浓硫酸的作用是___________________
(2)甲试管中混合溶液的加入顺序:___________________________________;
(3)上述实验中饱和碳酸钠溶液的作用是(填字母):_______________。
A.中和乙酸和乙醇。
B.中和乙酸并吸收部分乙醇。
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出。
D.加速酯的生成,提高其产率。
(4)欲将乙试管中的物质分离开以得到乙酸乙酯,必须使用的仪器有__________;分离时,乙酸乙酯应该从仪器________ (填:“下口放” 或“上口倒”)出。
(5)生成乙酸乙酯的反应是可逆反应,反应一段时间后,就达到了该反应的限度.下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) __________
①混合物中各物质的浓度不再变化;②单位时间里,生成1mol乙醇,同时生成1mol乙酸;③单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸.
难度: 中等查看答案及解析