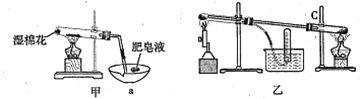
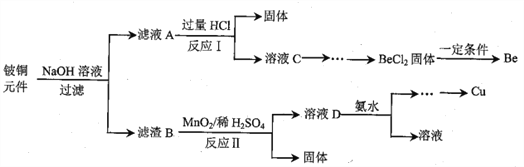
-
化学在生产和日常生活中有着重要的应用,下列说法不正确的是( )
A. 铁粉和碳粉的混合物可作食品抗氧化剂
B. 共享单车利用太阳能发电完成卫星定位,有利于节能环保
C. 补铁剂与维生素C共同服用可提高补铁效果
D. 光导纤维、醋酸纤维、硝酸纤维都是以纤维素为原料的化工产品
难度: 简单查看答案及解析
-
下列依据实验操作及现象得出的结论正确的是( )
选项
实验操作
现象
结论
A
向亚硫酸钠试样中滴入盐酸酸化的Ba(ClO)2 溶液
产生白色
沉淀
试样已氧化变质
B
向Co2O3中滴入浓盐酸
产生黄绿色
气体
氧化性: Co2O3>Cl2
C
向待测液中依次滴入氯水和KSCN溶液
溶液变为
红色溶液
待测液中含有Fe2+
D
向Na2SO4和Na2CO3混合溶液中滴入AgNO3 溶液
产生白色
浑浊
Ksp(Ag2SO4)<Ksp(Ag2CO3)
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
一种新药物结构如图所示,下列有关该化合物说法正确的是( )
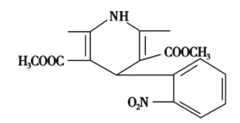
A. 分子式为C17H17N2O6
B. 能与氢气发生加成反应,但不能与溴的四氯化碳溶液反应
C. 能发生水解反应、聚合反应、取代反应
D. 分子中含有三种不同的官能团
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的数值。下列有关叙述正确的是( )
A. 7.8gNa2O2中阴离子所含的电子数为1.8NA
B. 标准状况下,22.4LCCl4中所含C—C1键的数目为4NA
C. 在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA
D. 在11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4反应中,6mol CuSO4能氧化白磷的分子数为1.1NA
难度: 中等查看答案及解析
-
W、X、Y、Z是原子序数依次增大的短周期主族元素,W是地壳中含量最多的元素,X和Z原子最外层电子数相同,Z的原子半径是同周期主族元素中最小的,Y原子的核电荷数是周期数的4倍。下列说法正确的是
A. 氢化物的沸点:X<Z
B. 简单离子半径:W>Z>X>Y
C. Y单质着火可用泡沫灭火器灭火
D. X单质可从W的简单氢化物中置换出W单质
难度: 中等查看答案及解析
-
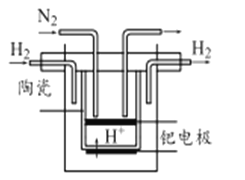
中国第二化工设计院提出,用间接电化学法对大气污染物NO进行无害化处理,其原理示意如图(质子膜允许H+和H2O通过),下列相关判断正确的是( )
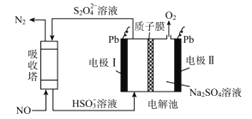
A. 吸收塔中的反应为2NO+2S2O32-+H2O=N2+4HSO3-
B. 电解池中质子从电极I向电极Ⅱ作定向移动
C. 电极I为阴极,电极反应式为2H2O+2e-=2OH-+H2
D. 每处理1 mol NO电解池质量减少16g
难度: 困难查看答案及解析
-
已知298K时,Ksp(NiS)=1.0×10-21,Ksp(NiCO3)=1.0×10-7 ;p(Ni)=-lg c(Ni2+),p(B)=-lg c(S2-)或-lg c(CO32-)。在含物质的量浓度相同的Na2S和Na2CO3的混合溶液中滴加Ni(NO3)2溶液产生两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。下列说法错误的是
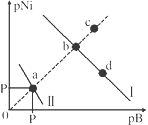
A. 常温下NiCO3的溶解度大于NiS的溶解度
B. 向d点对应的溶液中加入对应阴离子的钠盐,d点向b点移动
C. 对于曲线I,在b点加热,b点向c点移动
D. P为3.5且对应的阴离子是CO32-
难度: 中等查看答案及解析
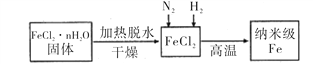

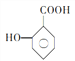 的一种同系物
的一种同系物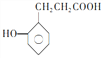 有多种同分异构体,其中符合下列要求的共有_____________种(不考虑立体异构),写出其中核磁共振氢谱为6组峰,且峰面积比为2:2:2:2:1:1的结构简式_____________
有多种同分异构体,其中符合下列要求的共有_____________种(不考虑立体异构),写出其中核磁共振氢谱为6组峰,且峰面积比为2:2:2:2:1:1的结构简式_____________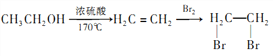 。
。