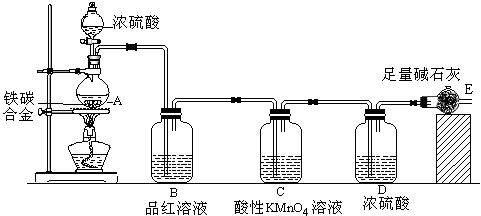
-
从化学角度分析,下列叙述不正确的是
A.利用太阳能蒸馏海水是海水淡化的方法之一
B.研制乙醇汽油技术,可降低机动车辆尾气中有害气体的排放
C.光缆在信息产业中有广泛应用,制造光缆的主要材料是单质硅
D.绿色化学的核心是利用化学原理从源头上减少和消除工农业生产等对环境的污染
难度: 简单查看答案及解析
-
设阿伏加德罗常数为NA,下列说法正确的是
A.用100ml 4mol/L盐酸与8.7gMnO2共热能制取氯气0.2NA
B.一定温度下0.1L 0.1mol/L的HA和1L0.01mol/L的HA所含A-微粒数均为0.01NA
C.在常温常压下,44g CO2与N2O的混合物中含有的原子总数为3 NA
D.1mol Cl2与足量的金属铝反应,转移电子数为3 NA
难度: 中等查看答案及解析
-
关于下列各装置图的叙述中,不正确的是
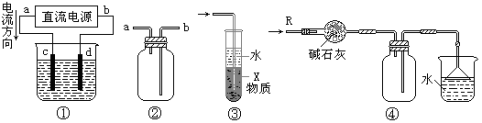
A.装置①中,d为阳极、c为阴极
B.装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体
C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
难度: 困难查看答案及解析
-
已知NO2和N2O4可以相互转化:2NO2(g)
N2O4(g);△H<0。现将一定量NO2和N2O4的混合气体通入体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图。下列说法正确的是
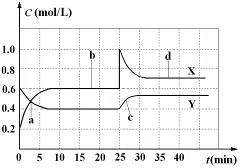
A.图中共有两条曲线X和Y,其中曲线y表示NO2浓度随时间的变化
B.a、b、c、d四个点中,表示化学反应处于平衡状态的点是b和c
C.反应进行至25 min时,曲线发生变化的原因是加入0.4 mol N2O4
D.若要达到与d相同的状态,在25 min时还能采取的措施是适当缩小容器体积
难度: 困难查看答案及解析
-
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:2CH3OH + 3O2 + 4OH—
2CO32— + 6H2O。则下列说法不正确的是
A.放电时CH3OH参与反应的电极为正极
B.充电时电解质溶液的pH逐渐增大
C.放电时负极的电极反应为:CH3OH-6e—+8OH—=CO32— +6H2O
D.充电时每生成1 mol CH3OH转移6 mol电子
难度: 中等查看答案及解析
-
香兰素是重要的香料之一,它可由丁香酚经多步反应合成。

有关上述两种化合物的说法正确的是
A.常温下,1 mol丁香酚只能与1 molBr2反应
B.丁香酚不能FeCl3溶液发生显色反应
C.1 mol香兰素最多能与3 mol氢气发生加成反应
D.香兰素分子中至少有12个原子共平面
难度: 中等查看答案及解析
-
①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液。相同条件下,有关上述溶液的比较中,不正确的是
A.水电离的c(H+):①=②=③=④
B.若将②、③溶液混合后,pH=7,则消耗溶液的体积:②=③
C.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:①最大
D.向溶液中加入100mL水后,溶液的pH:③>④>②>①
难度: 中等查看答案及解析