-
下列说法正确的是
A.摩尔是物质的数量单位 B.氢气的摩尔质量是2g
C.1molNH3的质量是17g D.1mol气体所占的体积约为22.4L
难度: 中等查看答案及解析
-
浊液区别于其他分散系最本质的特征是
A.外观混浊不清 B.分散质粒子不能透过半透膜
C.不稳定 D.分散质粒子直径大于10-7m
难度: 简单查看答案及解析
-
实验室里进行过滤和蒸发操作都要用到的仪器是
A.烧杯 B.玻璃棒 C.蒸发皿 D.酒精灯
难度: 简单查看答案及解析
-
中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700℃时制造出纳米级金刚石粉末。该成果发表在世界权威的《科学》杂志上,立刻被科学家们高度评价为“稻草变黄金”。同学们对此有下列一些理解,其中错误的是
A.金刚石属于非金属单质
B.制造过程中元素种类发生改变
C.CCl4是一种化合物
D.这个反应是置换反应
难度: 中等查看答案及解析
-
下列氯化物中,不能用金属单质和氯气直接反应制得的是
A.CuCl2 B.FeCl2 C.MgCl2 D.NaCl
难度: 中等查看答案及解析
-
下列说法正确的是
A.硫酸、纯碱、碳酸钠和生石灰分别属于酸、碱、盐和氧化物
B.生石灰与水混合的过程只发生物理变化
C.可用丁达尔效应区分溶液与胶体
D.CuSO4·5H2O是一种混合物
难度: 中等查看答案及解析
-
下列电离方程式书写正确的是
A.H2CO3 = 2 H + + CO32-
B.Ca(OH)2 = Ca2+ + (OH)2-
C.K2SO4 === 2K++SO4― 2
D.NaHCO3 = Na+ + HCO3-
难度: 简单查看答案及解析
-
下列说法中,正确的是
A.失去电子的物质是还原剂,具有氧化性
B.氧化还原反应的本质是元素化合价的升降
C.氧化还原反应中,某元素由化合态变为游离态,此元素可能被还原或被氧化
D.在氧化还原反应中,电子不可以在同种元素间转移
难度: 中等查看答案及解析
-
在标准状况下,下列物质中体积最大的是
A.3g H2 B.1mol SO2 C.36g H2O D.6.02×1023个N2
难度: 中等查看答案及解析
-
下图分别表示四种操作,其中有两处错误的是
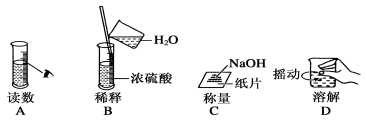
难度: 简单查看答案及解析
-
下列各溶液中,Na+ 浓度最大的是
A.5 L 1.2 mol·L-1的Na2SO4溶液
B.2 L 0.8 mol·L-1的NaOH溶液
C.1 L 1 mol·L-1的Na2CO3溶液
D.4 L 0.5 mol·L-1的NaCl溶液
难度: 中等查看答案及解析
-
在碱性溶液中能大量共存且溶液为无色透明的离子组是
A.K+、MnO4-、Na+、Cl-
B.K+、Na+、NO3-、CO32-
C.Na+、H+、NO3-、SO42-
D.Mg2+、Na+、Cl-、SO42-
难度: 中等查看答案及解析
-
下列说法正确的是
A.固体NaCl不导电,所以NaCl是非电解质
B.NH3、CO2的水溶液的导电,所以NH3、CO2是电解质
C.铜、石墨均能导电,所以它们都是电解质
D.蔗糖在水溶液中或熔融时均不导电,所以是非电解质
难度: 中等查看答案及解析
-
将0.01 molNa2SO4·10H2O 溶于水中,要使Na+离子数目与水分子数目之比为1:100,则需加入水的质量为
A.18g B.36g C.34.2g D.37.8g
难度: 中等查看答案及解析
-
下列说法正确的是
A.在常温常压下,11.2LN2所含有的分子数为0.5NA
B.在标准状况下, 22.4 L CO和N2的混合物的物质的量为1mol
C.在标准状况下, 18g H2O的体积为22.4 L
D.1mol SO2的体积为22.4 L
难度: 中等查看答案及解析
-
下列化学变化中,需加入氧化剂才能实现的是
A.C→CO2 B.CO2→CO C.CuO→Cu D.H2SO4→BaSO4
难度: 中等查看答案及解析
-
能用离子方程式H++OH-=H2O表示的化学方程式是
A.KOH+CH3COOH=CH3COOK+H2O
B.Ba(OH)2+H2SO4=BaSO4↓+2H2O
C.Cu(OH)2+H2SO4=CuSO4+2H2O
D.2NaOH+H2SO4=Na2SO4+2H2O
难度: 简单查看答案及解析
-
下列关于物质的量浓度表述正确的是
A.0.2 mol·L-1 Na2SO4溶液中含有SO42—物质的量为0.2 mol
B.50mL 2 mol·L-1 NaCl溶液和100mL 0.5mol·L-1MgCl2溶液中,Cl-的物质的量浓度相等
C.用1 L水吸收22.4 L氯化氢(标况下)所得盐酸的浓度是1 mol·L-1
D.10 g 98%的硫酸(密度为1.84g · cm—3)与10mL 18.4mol·L—1的硫酸的浓度是相同的
难度: 中等查看答案及解析