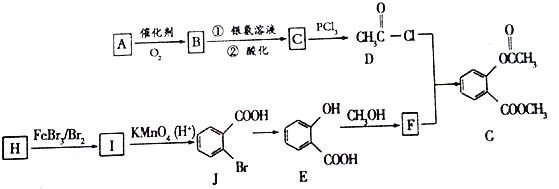
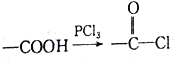-
下列说法中正确的是
A. “冰,水为之,而寒于水”说明相同质量的冰和水比较,冰的能量更高
B. “蜡炬成灰泪始干”中“泪”的主要成分是水
C. “南朝四百八十寺,多少楼台烟雨中。”的“烟雨”是由飘浮在空气中的固体小颗粒形成的
D. “榆荚只能随柳絮,等闲摭乱走空园。”中的“柳絮”和棉花的成分均含纤维素
难度: 简单查看答案及解析
-
设N A为阿伏加德罗常数的值,下列说法正确的是
A. 0.1mol/LNa2CO3溶液1L所含阴离子数目小于0.1N A
B. 常温常压下,3.2gCH4 中含有的电子数为2N A
C. 1molCl 2溶于足量的水中,反应时斯裂的Cl-Cl 键数目为N A
D. 标准状况下,11.2 LCH3CH2OH中含有的分子数为0.5N A
难度: 中等查看答案及解析
-
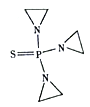
某有机物的结构简式为
。下列关于该有机物的叙述正确的是
A.该有机物属于芳香烃
B.该有机物苯环上一氯代物有6种
C.该有机物可发生取代、加成、加聚、消去反应
D.1 mol该有机物在适当条件下,最多可与3 mol Br2、5 mol H2反应
难度: 中等查看答案及解析
-
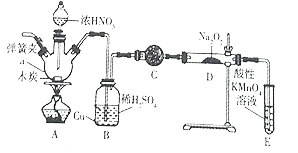
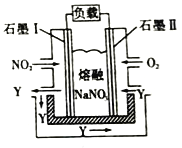
一种碳纳米管能够吸附氢气,可作充电电池( 如图所示)的碳电极,该电池的电解质溶液为6 mol/L KOH溶液,下列说法中正确的是
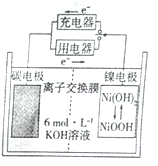
A. 放电时镍电极反应为:NiOOH +H2O +e-=Ni(OH)2 +OH-
B. 放电时碳电极反应为:2H+ +2e-= H2 ↑
C. 充电时将碳电极与电源的正极相连
D. 充电时阴极发生氧化反应
难度: 中等查看答案及解析
-
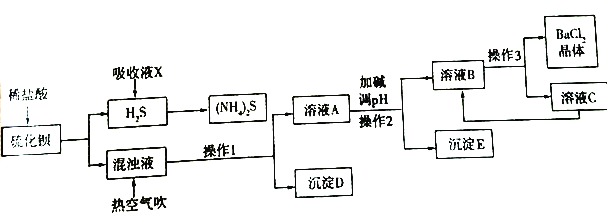
下列实验及现象不能得出相应结论的是
选项
实验操作
现象
结论
A
向碳酸钠和小苏打溶液中分别加入盐酸
都冒气泡
两者均能与盐酸反应产生使澄清石灰水变浑浊的气体
B
将FeSO4高温分解产生的气体通入品红溶液中
品红游液褪色
分解产生的气体中含有SO2
C
将一小块金属的放置在空气中,一段时间后,将其放置在坩埚中加热
钠表面变暗,加热时,钠钠易与氧气反应,加热时,钠燃烧,发出黄色火焰
钠易与氧气反应,加热时生成Na2O的速率加快
D
将KI 和FeCl3溶液在试管中混合后,加 入CCl4振 荡,静 置
下层溶液显紫红色
氧化性:Fe3+>I2
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
X、Y、Z、M、Q、R是6 种短周期元素,其原子半径及主要化合价如下:
元素代号
X
Y
Z
M
Q
R
原子半径/nm
0.160
0.143
0.102
0.089
0.074
0.037
主要化合价
+2
+3
+6,−2
+2
−2
+1
下列说法不正确的是
A. Q 和R 按原了个数比1∶1组成的化合物是一种“绿色”氧化剂
B. X、Y、Q的简单离子半径大小:Q>X>Y
C. Y 与M 的单质及其化合物性质相似
D. Q、Z 的气态氢化物的沸点随着相对分子质量增大依次升高
难度: 中等查看答案及解析
-
常温时,下列溶液的时或微粒的物质的量浓度关系正确的是
A. 0.1mol/LCH3COONa与0.1mol/LHCl等体积混合:c(Na+)=c(Cl-)>c((H+)>c(CH3COOH)
B. 0.1mol/L '的NaHA溶液,其pH=4,则:c(HA-)>c((H+)>c(H2A)>c(A2-)
C. 某物质溶液由水电离出的c(H+)=1×10-amol/L,若a>7时,则该溶液的pH一定为14-a
D. 将0.2mol/L的某一元HA溶液和0.1mol/LNaOH溶液等体积混合后溶液的pH大于7,则反应后的混合液2(OH-)+(A-)=2c(H+)+c(HA)
难度: 中等查看答案及解析