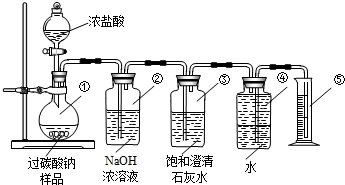
-
超临界流体是物质介于气态和液态之间的一种新的状态.目前应用最广的是超临界二氧化碳在化学工业上可取代氟利昂等溶剂、发泡剂.下列有关超临界二氧化碳的说法中错误的是( )
A.超临界二氧化碳由CO2分子聚集而成
B.超临界二氧化碳是新合成的一种物质
C.用超临界二氧化碳溶解物质后,可在常温常压下使二氧化碳挥发除去
D.用超临界二氧化碳代替氟利昂可减轻对臭氧层的破坏难度: 中等查看答案及解析
-
我国盛产的香料八角中存在莽草酸(化学式为C7H10O5),由它合成的达菲(化学式为C16H31O8N2P)是抗甲型H1N1流感的一种药物.下列说法正确的是( )
A.莽草酸属于氧化物
B.莽草酸中碳、氢、氧的质量比为7:10:5
C.达菲的相对分子质量为174
D.用莽草酸合成达菲时需要含氮的物质难度: 中等查看答案及解析
-
下列方程式符合题意且书写正确的是( )
A.医疗上用碱性物质中和过多胃酸:NaOH+HCl=NaCl+H2O
B.除去NaCl溶液中的少量MgCl2:2KOH+MgCl2=2KCl+Mg(OH)2↓
C.正常雨水呈酸性的原因:CO2+H2O=H2CO3
D.证明铁是金属活动性顺序表中氢之前的金属:2Fe+6HCl=2FeCl3+3H2↑难度: 中等查看答案及解析
-
“三效催化转换器”可将汽车尾气中有害气体处理为无污染的气体,如图为该反应的微观示意图,其中不同颜色球代表不同种原子.下列说法错误的是( )
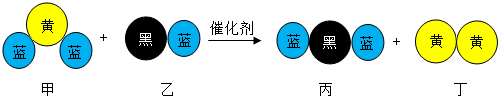
A.乙和丙中所含元素种类相同
B.甲和丁中同种元素化合价相等
C.该反应中共有三种元素
D.反应方程式中乙、丙的化学计量数均为4难度: 中等查看答案及解析
-
1.6g某物质在氧气中完全燃烧生成4.4g二氧化碳和3.6g水,关于该物质的组成有下列论断:
①一定含C、H;②一定不含O;③可能含O;④一定含O;⑤分子中C、H的原子个数比为1:2;⑥分子中C、H的原子个数比为1:4.其中正确的是( )
A.①②⑥
B.①②⑤
C.①③⑥
D.①④⑤难度: 中等查看答案及解析
-
在“绿色化学工艺”中,最好是反应物中原子全部转化为欲制得的产物,即原子的利用率为100%.在用C3H4(丙炔)合成C5H8O2(2-甲基丙烯酸甲酯)的过程中,欲使原子的利用率达到最高,在催化剂作用下还需要其他的反应物是( )
A.CO和CH3OH
B.CO2和H2O
C.H2和CO
D.CH3OH和H2难度: 中等查看答案及解析
-
向AgNO3、Cu(NO3)2和Zn(NO3)2的混合溶液中加入一定量的铁粉,充分反应后,有金属析出,过滤、洗涤后往滤渣中加入稀盐酸,有无色气体放出.则下列分析一定正确的是( )
A.滤出的固体中一定有Ag、Cu、Fe
B.滤出的固体中一定有Ag和Cu,可能有Fe
C.滤液中一定有的溶质Cu(NO3)2、Fe(NO3)2、Zn(NO3)2
D.滤液中一定有的溶质Zn(NO3)2、Fe(NO3)2难度: 中等查看答案及解析
-
要除去下列四种物质中的少量杂质(括号内的物质为杂质)
甲:CaCO3(Na2CO3)乙:NaOH(Na2CO3)丙:KCl(KHCO3)丁:炭粉(CuO)
可选用的试剂及操作方法有:①加适量盐酸,搅拌,过滤;②加适量水,搅拌,过滤;③加适量盐酸,蒸发;④溶解,加适量石灰水,过滤,蒸发.下列组合正确的是( )
A.甲-②,乙-④
B.乙-③,丙-①
C.丙-①,丁-②
D.丁-①,丙-③难度: 中等查看答案及解析
-
下列图①~④分别与相应的操作过程相对应,其中正确的是( )
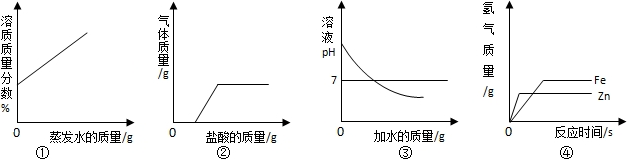
A.①在恒温的条件下,将足量的氯化钠饱和溶液蒸发适量的水分
B.②向露置在空气中部分变质的氢氧化钠溶液中加入稀盐酸
C.③向氢氧化钠溶液中不断加水稀释
D.④相同质量的且过量的锌粉和铁粉,分别与质量和质量分数相同的稀盐酸反应难度: 中等查看答案及解析
-
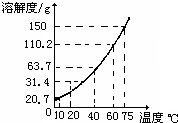
甲、乙两种固体的溶解度曲线如右下图.将①②两试管中的甲、乙饱和溶液(均有少量未溶解的固体)放进盛有热水的烧杯里.升高温度后,下列有关说法正确的是( )
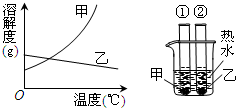
A.①②两溶液的质量一定相等
B.①②两溶液均变为不饱和溶液
C.①溶液质量增加,②溶液质量减少
D.①溶液中溶质的质量分数一定大于②溶液难度: 中等查看答案及解析