-
2010年上海世博实现了环保世博、生态世博目标,下列做法不符合这一目标的是( )
A.推广和使用电动汽车
B.利用太阳能作为能源
C.在停车场安装催化光解设施处理汽车尾气
D.把世博会期间产生的垃圾焚烧或深埋处理难度: 中等查看答案及解析
-
53131I是日本核泄漏的元素之一,较大量接触对人体有害,所以不必“谈碘色变”.53131I在人类生活中还有着“天使”的一面,如控制剂量在医疗上有助于治疗多种甲状腺疾病.下面对53131I的叙述中错误的是( )
A.质子数与电子数均为53
B.中子数与质子数之差为25
C.电子数与中子数均为78
D.质子数与中子数之和为131难度: 中等查看答案及解析
-
下列有关化学用语错误的是( )
A.次氯酸的结构式:H-O-Cl
B.CH4分子的比例模型:
C.丙烷分子的球棍模型:
D.CO2的电子式: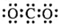
难度: 中等查看答案及解析
-
在灾区,为防止疾病传染,河水需处理后方可饮用,常用的处理方法有:①加热煮沸,②过滤,③投药消毒,④自然沉降.较合理的顺序为( )
A.③②④②
B.④②③①
C.③①④②
D.④①③②难度: 中等查看答案及解析
-
某种氟氯烃(以A代替其化学式)可破坏臭氧层,其反应过程可表示为A+O3→AO+O2,AO+O→A+O2,根据所学知识可知氟氯烃在反应中的作用( )
A.氧化剂
B.还原剂
C.催化剂
D.稳定剂难度: 中等查看答案及解析
-
下列事实不属于盐类水解应用的是( )
A.明矾和氯化铁晶体在生产中常作净水剂
B.实验室通常使用热的纯碱溶液去除油污
C.实验室配制FeCl3溶液时加少量稀盐酸
D.实验室制氢气时加CuSO4加快反应速率难度: 中等查看答案及解析
-
由A、B、C、D四种金属按表中装置进行实验,下列叙述中正确的是( )
实验装置与现象 装置 甲 乙 丙
现象 二价金属A不断溶解 C的质量增加 A上有气体产生
A.装置甲中的B金属是原电池的负极
B.装置乙中的C金属是原电池的阴极
C.装置丙中的D金属是原电池的正极
D.四种金属的活泼性顺序是D>A>B>C难度: 中等查看答案及解析
-
XY是中学化学中常见的化合物,已知组成该物质的两种离子的电子层结构与Ne相同.下列有关说法中错误的是( )
A.微粒通过离子键结合在一起
B.Y的原子序数比X的大
C.Y离子半径比X离子半径大
D.Y单质的氧化性比X强难度: 中等查看答案及解析
-
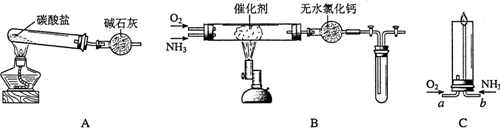
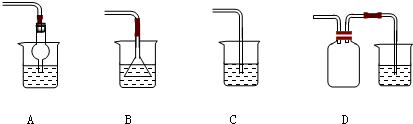
关于下列各实验装置图的叙述中,正确的是( )
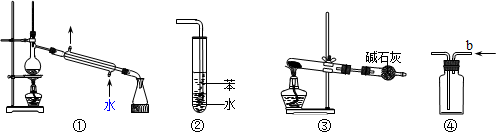
A.装置①可用于分离苯和溴苯的混合物
B.装置②可用于吸收HCl或NH3气体
C.装置③可用于分解NH4Cl制备NH3
D.装置④b口进气可收集CO2或NO气体难度: 中等查看答案及解析
-
北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开.S-诱抗素的分子结构如图,下列关于该分子的说法中错误的是( )
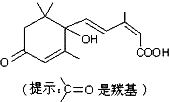
A.该分子含有碳碳双键、羟基、羰基、羧基
B.该分子能使溴水或酸性高锰酸钾溶液褪色
C.该分子与氢氧化钠共热时能发生水解反应
D.该分子不能与银氨溶液发生反应产生银镜难度: 中等查看答案及解析
-
下列叙述中正确的是( )
A.晶体中分子间的作用力越大,分子越稳定
B.原子晶体中,若共价键越强,熔点就越高
C.有化学键断裂的变化,就一定是化学变化
D.熔化状态下能导电的物质一定是离子晶体难度: 中等查看答案及解析
-
工业合成氨的正反应是放热反应,下列关于N2(g)+3H2(g)⇌2NH3(g)反应的图象中,错误的是( )
A.
B.
C.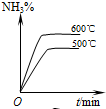
D.
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是( )
A.向氯化亚铁溶液中通入氯气:Fe2++Cl2→Fe3++2Cl-
B.向过量的氨水中滴入少量氯化铝溶液:Al3++4NH3.H2O→AlO2-+4NH4++2H2O
C.向碳酸氢钙溶液中加入足量的氢氧化钠溶液:Ca2++HCO3-+OH-→CaCO3↓+H2O
D.用氢氧化钠溶液吸收少量二氧化碳:2OH-+CO2→CO32-+H2O难度: 中等查看答案及解析
-
传统的“陈醋”生产过程中有一步称为“冬捞夏晒”,是指冬天捞出醋中的冰、夏日暴晒蒸发醋中的水分,以提高醋的品质.下列结论错误的是( )
A.食醋中的水要比醋酸容易蒸发
B.调味品的食醋含3%-5%的乙酸
C.食醋可除去热水瓶胆中的水垢
D.冰醋酸是由冰和醋酸混合而成难度: 中等查看答案及解析
-
实验室一瓶固体M的标签右半部分已被腐蚀,剩余部分只看到“Na2S”字样(如图所示).已知,固体M只可能是Na2SO3、Na2SiO3、Na2SO4中的一种.若取少量固体M配成稀溶液进行有关实验,下列说法错误的是( )
A.只用盐酸一种试剂就可以确定该固体M的具体成分
B.往溶液中通入二氧化碳,若有白色沉淀,则固体M为Na2SiO3
C.测定溶液的酸碱性,若溶液显中性,则固体M一定是Na2SO4
D.往溶液中加硝酸酸化的BaCl2,若有沉淀,则固体M为Na2SO4难度: 中等查看答案及解析
-
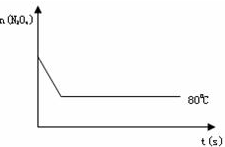
某实验报告记录了如下数据,其中数据合理的是( )
A.用pH试纸测得氯水的pH为2.1
B.用50mL量筒量取23.00mL浓盐酸
C.用温度计测量出酒精的沸点为78.5℃
D.用托盘天平称量氧化铜粉末为11.70g难度: 中等查看答案及解析
-
实验室中,通常以草酸钠(Na2C2O4)为标准液,通过氧化还原滴定来测定高锰酸钾溶液的浓度,其反应的化学方程式为:C2O42-+MnO4-+H+-Mn2++CO2↑+H2O(未配平)下列有关草酸钠滴定高锰酸钾实验的叙述,正确的是( )
A.滴定过程中,高锰酸钾被氧化,草酸钠被还原
B.温度需超过100℃,草酸钠与高锰酸钾才会反应
C.反应中,消耗的草酸钠与高锰酸钾的物质的量之比为5:2
D.为便于滴定终点的判断,滴定时必须往体系中加入指示剂难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
A.室温下,42.0g乙烯和丙烯的混合气体中含有的碳原子数为3NA
B.100mL 18.4mol•L-1硫酸与足量铜反应,生成S02的分子数为0.92NA
C.1L 0.1mol•L-1的醋酸溶液中所含的离子和分子总数为0.1NA
D.标准状况下,1L液态水中含有的H+数目小于10‑7NA难度: 中等查看答案及解析
-
常温下将V1mL c1mol/L的NaOH溶液滴加到V2mL c2mol/L的CH3COOH 溶液中,下列结论正确的是( )
A.若V1=V2,c1=c2则溶液一定存在c(H+)=c(OH-)
B.若混合溶液的pH=7,则一定存在c1V1<c2V2
C.若混合溶液的pH=7,则一定存在c(Na+)=c(CH3COO-)
D.若混合溶液的pH>7,则一定是由于NaOH过量造成的难度: 中等查看答案及解析
-
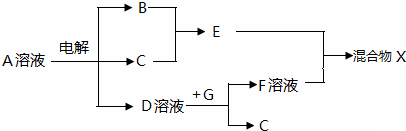
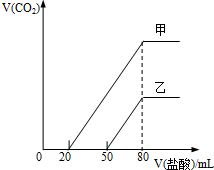
向由盐酸、碳酸钠、硫酸、氯化铜、氯化钠中的一种或几种混溶形成的稀溶液中,滴入氢氧化钡溶液,产生沉淀的量与加入氢氧化钡溶液体积的关系如图所示,则下列关于该溶液中溶质的判断正确的是( )
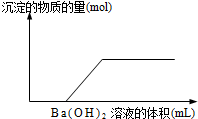
A.可能含有氯化钠
B.肯定没有稀盐酸
C.肯定含有氯化铜
D.可能含有两种酸难度: 中等查看答案及解析
-
在一定温度下,向一个容积不变的容器中,加入2mol N2和8mol H2及固体催化剂,使之反应,平衡时容器内气体压强为起始时的80%,该反应的热化学方程式为:N2(g)+3H2(g)→2NH3(g)+92kJ.下列叙述中正确的是( )
A.平衡时,NH3的体积分数为20%,放出的热量小于92.2kJ
B.平衡时,NH3的体积分数为25%,放出的热量等于92.2kJ
C.平衡时,NH3的物质的量为2mol,放出的热量大于92.2kJ
D.平衡时,NH3的物质的量为4mol,放出的热量等于184.4kJ难度: 中等查看答案及解析
-
将2.8克Fe在一定量稀硝酸中恰好完全溶解后,往溶液中滴加NaOH 溶液立即产生沉淀,滴加至沉淀量最大时,再将所得溶液和沉淀一起加热蒸干,并在空气中灼烧至恒重,所得固体成分和可能的质量为( )
A.FeO3.6gNaNO312.75g
B.Fe2O34gNaNO26.9g
C.Fe3O43.87gNaNO310.25g
D.Fe2O34gNaNO29.8g难度: 中等查看答案及解析