-
化学与生产、生活密切相关,下列叙述错误的是
A.用热的纯碱溶液清除灶具上的油污
B.用Na2S作沉淀剂,除去废水中的Cu2+和Hg2+
C.用硫酸清洗锅炉中的水垢
D.用明矾[KAl(SO4)2·12H2O]作净水剂,除去水中悬浮的杂质
难度: 中等查看答案及解析
-
下列离子既能电离又能水解,且能与强碱溶液反应的是
A.CH3COO- B.HSO4- C.HSO3- D.CO32-
难度: 中等查看答案及解析
-
25℃时,水的电离可达到平衡:H2O
H++OH-,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量固体CH3COOH,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
难度: 中等查看答案及解析
-
在加入铝粉能产生H2的溶液中下列各组离子可能大量共存的是
A.NO3- K+ [Al(OH)4]- OH-
B.Na+ Ba2+ Mg2+ HCO3-
C.NO3- Mg2+ K+ Cl-
D.NH4+ NO3- CO32- Na+
难度: 中等查看答案及解析
-
下列各式中属于正确的水解反应的离子方程式的是
A.CH3COOH+OH-
CH3COO-+H2O
B.S2-+2H2O
H2S+2OH-
C.CH3COOH+H2O
CH3COO-+H3O+
D.NH4++H2O
NH3•H2O+H+
难度: 中等查看答案及解析
-
已知0.1 mol•L-1的二元酸H2A溶液的pH=4,则下列说法中正确的是
A.在Na2A、NaHA两溶液中,离子种类不相同
B.物质的量浓度相等的Na2A、NaHA两溶液的pH相大小为前者小于后者
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-)
D.在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-)
难度: 困难查看答案及解析
-
下列叙述不正确的是
A.0.1 mol•L-1氨水中,c(OH-)>c(NH4+)
B.等体积等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
C.在0.1 mol•L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
D.0.1 mol•L-1某二元弱酸强碱盐Na2A溶液中,c(Na+)=2c(A2-)+2c(HA-)+2c(H2A)
难度: 困难查看答案及解析
-
有关常温下pH均为3的酸酸和硫酸的说法正确的是
A.分别加水稀释100倍后,两种溶液的pH仍相同
B.醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相等
C.分别加入足量锌片,两种溶液生成H2的体积相同
D.两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol•L-1
难度: 中等查看答案及解析
-
常温下,下列溶液中的离子浓度关系正确的是
A.pH=3的醋酸溶液中:c(H+)=c(CH3COO-)=3.0 mol•L-1
B.Na2S溶液中:c(Na+)>c(HS-)>c(OH-)>c(H2S)
C.pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
D.pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
难度: 困难查看答案及解析
-
往含I-和Cl-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示。则原溶液中c(Br-)/c(Cl-)的比值约为
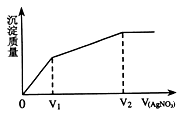
A.V1/(V2-V1) B.V1/V2 C.(V2-V1)/V1 D.V2/V1
难度: 困难查看答案及解析
-
在蒸发皿中加热蒸干再加热(低400℃)下列物质的溶液,可以得到该物质固体的是
A.AlCl3 B.Na2CO3 C.Na2SO3 D.MgSO4
难度: 中等查看答案及解析
-
下列溶液一定呈中性的是
A.pH=7的溶液
B.使石蕊试液呈紫色的溶液
C.c(H+)=c(OH-)=10-6 mol/L的溶液
D.酸与碱恰好完全反应生成正盐的溶液
难度: 简单查看答案及解析
-
下列有关实验的说法正确的是
A.用干燥的pH试纸测定新制氯水的pH
B.中和滴定实验中,洗净后的锥形瓶不需要干燥
C.用Na2S溶液与AlCl3溶液混合制取Al2S3
D.向白色ZnS沉淀上滴加CuSO4溶液,沉淀变为黑色,说明Ksp(ZnS)<Ksp(CuS)
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是
A.FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
B.硫酸亚铁溶液中加过氧化氢溶液:Fe2++2H2O2+4H+=Fe3++4H2O
C.用氨水吸收少量二氧化硫:NH3·H2O+SO2=NH4++HSO3-
D.硝酸铁溶液中加过量氨水:Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+
难度: 困难查看答案及解析
-
要使K2S溶液中c(K+)/c(S2-)的比值变大,可加入适量的物质是
A.盐酸 B.KHS溶液
C.NaOH溶液 D.Na2S溶液
难度: 中等查看答案及解析
-
已知:25℃时,Ksp[Mg(OH)2]=5.61×10-12 mol•L-1,,K[MgF2]=7.43×10-11.下列说法正确的是
A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
C.25℃时,Mg(OH)2固体在20 mL 0.01 mol•L-1氨水中的Ksp比在20 mL 0.01 mol•L-1NH4Cl溶液中的Ksp小
D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2
难度: 困难查看答案及解析
-
醋酸溶液中存在电离平衡:CH3COOH
CH3COO-+H+,下列叙述不正确的是
A.CH3COOH溶液中离子浓度的关系满足:c(H+)>c(CH3COO-)
B.CH3OOH溶液中加入少量CH3COONa固体,平衡逆向移动
C.0.1mol/L的CH3COOH溶液加水稀释,溶液中的离子浓度均减小
D.常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH=7
难度: 中等查看答案及解析
-
常温下,用NaOH溶液滴定20.00mL0.1 mol•L-1CH3COOH溶液所得滴定曲线如图,下列说法正确的是
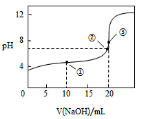
A.点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B.点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-)
C.点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
难度: 困难查看答案及解析
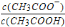 =_____;
=_____;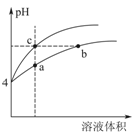
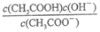 d.
d.