-
化学与我们的生活息息相关,下列说法正确的是( )
A.红宝石、玛瑙、水晶、钻石的主要成分都是硅酸盐
B.三大合成材料是指塑料、合成纤维和合成橡胶
C.石油裂解、煤的汽化、海水蒸馏的过程中都发生了化学变化
D.鸟巢使用了高强度、高性能的钒氮合金高新钢,铁合金熔点、硬度均比纯铁高难度: 中等查看答案及解析
-
下列说法正确的是( )
A.醋酸铅可使蛋白质发生盐析
B.饱和溴水可用于鉴别苯和甲苯
C.乙醇可被重铬酸钾酸性溶液氧化为乙酸
D.溶液由饱和变为不饱和,溶质的质量分数减小难度: 中等查看答案及解析
-
下表中元素均为中学化学中常见短周期元素,根据表中信息,下列说法不正确的是
( )元素代号 X Y Z W N 原子半径/nm 0.186 0.074 0.102 0.099 0.160 主要化合价 +1 -2 -2+6 +7-1 +2
A.W、N形成的化合物中含有极性键
B.常温下单质与水反应速率:X>N
C.最高价氧化物对应水化物酸性:W>Z
D.一种18电子的含Y的化合物属于共价化合物难度: 中等查看答案及解析
-
下列结论正确的是( )
A.向氯化铝溶液中滴加过量氨水,反应的离子方程式是:Al3++4NH3•H2O=AlO2-+4NH4++2H2O
B.足量铜与含1 mol溶质的浓硫酸反应,可生成0.5 mol SO2
C.碱性锌锰电池工作时,电子由MnO2经外电路流向Zn 极
D.15.6 g过氧化钠与足量二氧化碳充分反应,转移电子数为1.204×1023难度: 中等查看答案及解析
-
常温下,下列结论正确的是( )
A.pH 均为11的氨水和碳酸钠溶液中,由水电离出的c(OH-)均为10-3mol/L
B.pH均为3的醋酸溶液和盐酸,醋酸溶液的物质的量浓度大于盐酸的物质的量浓度
C.pH为3.6的0.1 mol/L HX与0.1 mol/L NaX的混合溶液中,c(Na+)=2c(X-)
D.向100 ml 0.1mol/L的氢氧化钠溶液中通入标况下224 m LCO2,充分反应后溶液中c(HCO3-)+c(H2CO3)+c(OH-)=c(Na+)难度: 中等查看答案及解析
-
有关下列四组实验描述正确的是( )
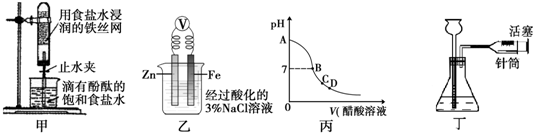
A.打开甲中的止水夹,一段时间后,可观察到试管中有黄绿色气体生成
B.向乙中铁电极区滴入2滴铁氰化钾,一段时间后,可观察到烧杯中有蓝色沉淀生成
C.丙表示用醋酸溶液滴定氢氧化钠溶液过程中的pH变化示意图,C点c(Na+)<c(CH3COO-)
D.用手捂住丁中锥形瓶,若长颈漏斗中液面未上升,说明装置漏气难度: 中等查看答案及解析
-
X、Y、Z、W均为中学化学中常见物质,一定条件下它们之间有如下转化关系(其它产物已略去):
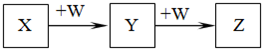
下列说法不正确的是( )
A.若W是强氧化性的单质,则X可能是金属铝
B.若W是氢氧化钠,则X水溶液为酸性
C.若W是单质铁,则Z溶液可能是FeCl2溶液
D.若W是氧气,则X、Z的相对分子质量可能相差14难度: 中等查看答案及解析
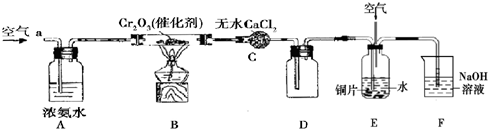
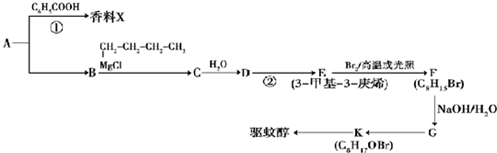
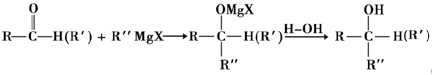 (X代表卤原子)
(X代表卤原子)