-
生活中碰到的某些问题和物质,常涉及到化学知识,下列分析不正确的是
A.维生素A:
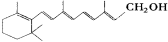 它是一种难溶于水的醇
它是一种难溶于水的醇B.用灼烧并闻气味的方法区别纯棉织物和纯毛织物
C.某雨水样品采集后放置一段时间,pH值由4.68变为4.28,是因为水中溶解了较多的CO2
D.金属材料都是导体,非金属材料不都是绝缘体
难度: 中等查看答案及解析
-
下列实验操作与实验目的或结论一致的是
选项
实验操作
实验目的或结论
A
取酸雨试样,加入10%H2O2溶液,再加入BaCl2溶液,有白色沉淀生成
该酸雨试样中一定含有H2SO4
B
将锌片和银片用导线连接后同时插入盛有稀硫酸的烧杯中,银片表面产生大量气泡
形成的原电池中锌作负极,银作正极
C
某无色溶液,加银氨溶液,水浴加热,有银镜生成
溶液中一定含有醛类化合物
D
配制FeCl2溶液时,先将FeCl2溶于适量稀硝酸,再用蒸馏水稀释,最后在试剂瓶中加入少量的铁粉
抑制Fe 2+水解,并防止Fe 2+被氧化为Fe3+
难度: 中等查看答案及解析
-
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素。其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图所示。下列说法正确的是
A.五种元素中,原子半径最大的是W
B.Y的简单阴离子比W的简单阴离子还原性强
C.Y与Z形成的化合物都可以和盐酸反应
D.Z与Q形成的化合物水溶液一定显酸性
难度: 中等查看答案及解析
-
下列说法正确的是
A.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)的熵增
B.铅蓄电池放电时的负极和充电时的阴极均发生氧化反应
C.常温下Ksp(Ag2CrO4)=1.1×10-12,Ksp(AgCl)=1.8×10-10,则Ag2CrO4的溶解度小于AgCl
D.等体积、物质的量浓度的HA与NaA(HA为弱酸)混合溶液,其酸碱性取决于Ka(HA)的大小
难度: 简单查看答案及解析
-
A-D是含同一元素的四种物质,相互之间有如图的转化关系,其中A是单质,D是最高价氧化物的水合物。那么A不可能是
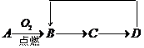
A.S B.Si C.Al D.Fe
难度: 中等查看答案及解析
-
下列是三种有机物的结构简式

下列说法正确的是
A.三种有机物都能发生水解反应
B.三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种
C.三种物质中,其中有两种互为同分异构体
D.三种物质在一定条件下,均可以被氧化反应
难度: 中等查看答案及解析
-
在水电离出c(H+)=1.0×10-12mol/L的溶液中,一定能大量共存的离子组是
A.Na+、K+、Br-、NO3-
B.K+、NH+4、CO32-、Br-
C.Fe2+ 、Na+、MnO4-、Cl-
D.Cu2+、Na+、Cl-、SO42-
难度: 困难查看答案及解析
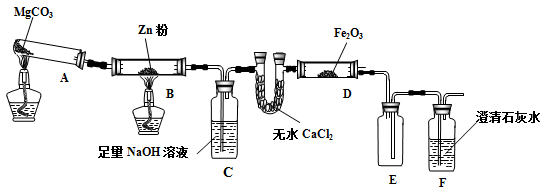
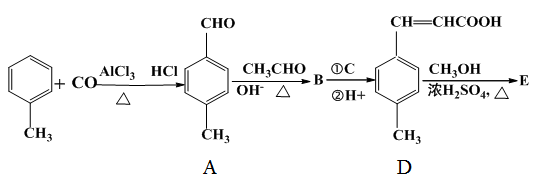
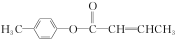 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为___________________________。
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为___________________________。