-
化学与生活、科技、医药、工业生产均密切相关,下列有关化学叙述正确的是
A. “大漠孤烟直”描述的是物质升华的过程
B. 《本草经集注》中关于鉴别硝石(KNO3)和朴硝(Na2SO4)的记载:“以火烧之,紫青烟起,乃真硝石也”,该方法应用了焰色反应
C. 误食重金属盐引起的人体中毒,可喝大量的食盐水解毒
D.
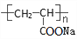 表示一种高分子树脂,因难溶于水,不具备吸水性
表示一种高分子树脂,因难溶于水,不具备吸水性难度: 简单查看答案及解析
-
下列说法正确的是(NA表示阿伏伽德罗常数)
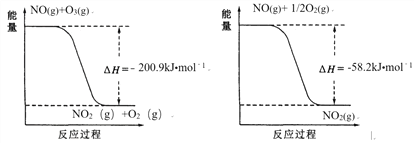
A. 反应TiO2(s) + 2Cl2(g)=TiCl4(g) + O2(g) ΔH>0能自发进行,其原因是ΔS>0
B. 地下钢铁管道用导线连接锡块可以减缓管道的腐蚀
C. 常温下KspMg(OH)2=5.6×10−12,则pH=10含Mg2+的溶液中,c(Mg2+)≤5.6×10−8 mol·L−1
D. 1molCl2溶于水后,溶液中Cl2、HClO、ClO-、Cl-四种粒子总数为2NA
难度: 中等查看答案及解析
-
四种短周期元素W、X、Y、Z的原子序数依次增大,W元素的最外层电子数是其电子层数的二倍;X的原子半径是短周期主族元素原子中最大的;Y是地壳中含量最多的金属元素;X与Z形成的离子化合物的水溶液呈中性。下列叙述中,不正确的是
A. 将W的最高价氧化物通入到Na2SiO3溶液中,生成白色沉淀,得出非金属性:W>Si
B. 将X单质投入到CuSO4溶液中,生成紫红色固体
C. 工业上用电解熔融Y的氧化物的方法冶炼金属Y
D. Z的气态氢化物的沸点在同主族中最低
难度: 中等查看答案及解析
-
生活中常见的荧光棒的发光原理可用下式表示:
+H2O2 → 2
+ 2CO2
二苯基草酸酯
上述反应产生的能量传递给荧光染料分子后,染料分子释放荧光。下列说法不正确的是
A. 可用氯化铁溶液检验上述反应有苯酚生成
B. 荧光棒发光过程涉及化学能到光能的转化
C. 二苯基草酸酯苯环上的一氯代物共有3种
D. 二苯基草酸酯与草酸二甲酯互为同系物
难度: 中等查看答案及解析
-
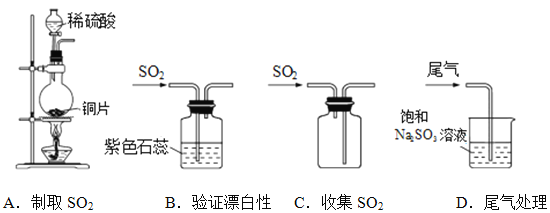
下列实验操作和现象对应所得到的结论均正确的是
选项
实验操作和现象
结论
A
向盛有X溶液的试管中滴入浓NaOH溶液,将干燥的红色石蕊试纸置于试管口,无明显现象
X溶液中无NH4+
B
室温下,用pH试纸测得:0.1mo/L Na2SO3溶液的pH约为10;0.1mol/L NaHSO3溶液的pH约为5
HSO3-结合H+的能力比
SO32-的强
C
将硫的酒精溶液滴入一定量的热水中得淡蓝色透明液体,用激光笔照射,有光亮的通路
淡蓝色液体属于胶体
D
常温下,测定盐酸和醋酸溶液的pH:
盐酸小于醋酸
证明相同条件下,在水中HCl电离程度大于CH3COOH
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
25 ℃时,将 1.0 L w mol·L-1 CH3COOH 溶液与 0.1 mol NaOH固体混合,充分反应。然后向混合液中加入CH3COOH或CH3COONa固体(忽略体积和温度变化),溶液pH的变化如图。下列叙述正确的是
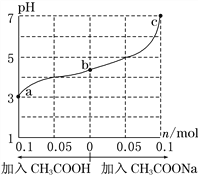
A. b点混合液中c(Na+)>c(CH3COO-)
B. 加入CH3COOH过程中,
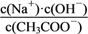 增大
增大C. c点存在:c(CH3COOH)+c(CH3COO-) =0.1+w
D. a、b、c对应的混合液中,水的电离程度由大到小的顺序是c>a>b
难度: 中等查看答案及解析


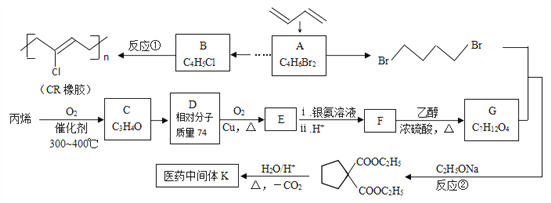
 。 恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.1molCl2。10min达平衡,测得10min内v(ClNO)=0.005mol/(L·min),则平衡后n(Cl2)=________mol。若其它条件不变,上述反应在恒压条件下进行,平衡时NO 的转化率______(填“增大”、“减小”或“不变”),此条件下的平衡常数K值为_______
。 恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.1molCl2。10min达平衡,测得10min内v(ClNO)=0.005mol/(L·min),则平衡后n(Cl2)=________mol。若其它条件不变,上述反应在恒压条件下进行,平衡时NO 的转化率______(填“增大”、“减小”或“不变”),此条件下的平衡常数K值为_______