-
下列有关金属腐蚀与防护的说法正确的是( )
A.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阴极的阳极保护法
B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C.纯银器表面在空气中因化学腐蚀渐渐变暗
D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
难度: 中等查看答案及解析
-
在下列给定条件的溶液中,一定能大量共存的离子组是( )
A.无色溶液:Ca2+、Fe3+、Cl-、NO3-
B.能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3-
C.FeCl3溶液:K+、Na+、SO42-、AlO2-
D.
mol/L的溶液:Na+、K+、SiO32-、NO3-
难度: 困难查看答案及解析
-
下列用来表示物质变化的化学用语中,正确的是( )
A.钢铁发生电化学腐蚀的正极反应式为:Fe-2e-=Fe2+
B.氢氧燃料电池的负极反应式为:O2+2H2O+4e-=4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+
D.电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑
难度: 中等查看答案及解析
-
用铜片、银片、Cu (NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是
①在外电路中,电流由铜电极流向银电极 ②正极反应为:Ag++e-=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A. ①② B.②③ C.②④ D.③④
难度: 中等查看答案及解析
-
有一合金由X、Y、Z、W四种金属组成
①若将合金放入盐酸中只有Z、Y能溶解
②若将合金置于潮湿空气中,表面只出现Z的化合物
③若将该合金作阳极,用X盐溶液作电解质溶液,通电时四种金属都以离子形式进入溶液中,但在阴极上只析出X。这四种金属的活动性顺序是( )
A.Y>Z>W>X B.Z>Y>W>X
C.W>Z>Y>X D.X>Y>Z>W
难度: 中等查看答案及解析
-
如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。则以下说法正确的是( )
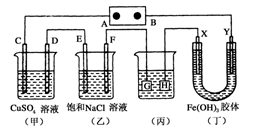
A.电源B极是正极
B.(甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量比为1:2:2:2
C.装置(丁)中X极附近红褐色变浅,说明氢氧化铁胶体带正电荷
D.欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
难度: 中等查看答案及解析
-
下列装置中,Fe腐蚀由快到慢的顺序为( )

A.⑤④③②①
B.⑤④①②③
C.⑤③④①②
D.①②④③⑤
难度: 中等查看答案及解析
-
草酸是二元弱酸,草酸氢钾溶液呈酸性。在O.1mol·L-1 KHC2O4溶液中,下列关系正确的是( )
A.c(K+)+c(H+) = c(HC2O4-)+c(OH-)+c(C2O42-)
B.c(HC2O4-)+c(C2O42-) = 0.1 mol·L-1
C.c(C2O42-) < c(H2C2O4)
D.c(K+) = c(H2C2O4)+c(HC2O4-)+c(C2O42-)
难度: 困难查看答案及解析
-
把Ca(OH)2固体放入一定量的蒸馏水中,一定温度下达到平衡:Ca(OH)2(s)
Ca2+(aq)+2OH-(aq)。向悬浊液中加少量生石灰,若温度保持不变 ,下列判断正确的是 ( )
A.溶液中Ca2+ 数目增多 B.溶液中c(Ca2+)增大
C.溶液pH值不变 D.溶液pH值增大
难度: 中等查看答案及解析
-
用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入 0.1molCu(OH)2后恰好恢复到电解前的浓度和PH。则电解过程中转移的电子数为( )
A.0.1mol B.0.2mol C.0.3mol D.0.4mol
难度: 中等查看答案及解析
-
某金属元素R的硝酸盐R(NO3)n溶液用Pt电极电解,阳极产生气体V L(标准状况)时,阴极质量增加m g,若R的原子量为M,下列叙述中不正确的是 ( )
A.电路中通过电子
mol B.n=
C.溶液中H+增加
mol D.n=
难度: 中等查看答案及解析
-
如下图是工业电解饱和食盐水的装置示意图,下列有关说法中不正确的是( )

A.装置中出口①处的物质是氯气,出口②处的物质是氢气
B.该离子交换膜只能让阳离子通过,不能让阴离子通过
C.装置中发生反应的离子方程式为:2Cl-+2H+
Cl2↑+H2↑
D.该装置是将电能转化为化学能
难度: 中等查看答案及解析
-
下列对化学平衡移动的分析中,不正确的是( )
①已达平衡的反应:C(s)+H2O(g)
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g)
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③有气体参加的反应平衡时,若减小反应器容积,平衡一定向气体体积增大的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A.①④ B.①②③ C.②③④ D.①②③④
难度: 困难查看答案及解析
-
下列与有机物的结构、性质相关的叙述错误的是( )
A.乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2
B.蛋白质和油脂都属于高分子化合物,一定条件下都能水解
C.甲烷和氯气反应生成一氯甲烷、苯和硝酸反应生成硝基苯的反应类型相同
D.苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键
难度: 中等查看答案及解析
-
室温下向10 mL pH = 3的醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.溶液中C(CH3COO-)/C(CH3COOH).c(OH-)不变
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10 mL pH = 11的NaOH溶液,混合液pH=7
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.一定温度下,反应MgCl2(l) =Mg(l)+Cl2(g)的ΔH < 0、ΔS > 0
B.水解反应NH4++H2O
NH3·H2O+H+达到平衡后,升高温度平衡逆向移动
C.铅蓄电池放电时的负极和充电时的阳极均发生还原反应
D.对于反应2H2O2===2H2O+O2↑, 加入MnO2或升高温度都能加快O2的生成速率
难度: 中等查看答案及解析
-
乙酸乙酯能在多种条件下发生水解反应:CH3COOC2H5+H2O
CH3COOH+C2H5OH已知该反应的速率随c(H+)的增大而加快。图为CH3COOC2H5的水解速率随时间的变化图。下列说法中正确的是( )

A.反应初期水解速率增大可能是溶液中c(H+)逐渐增大所致
B.A、B两点表示的c(CH3COOC2H5)相等
C.图中t0时反应达到平衡状态
D.tB时CH3COOC2H5的转化率低于tA时CH3COOC2H5的转化率
难度: 中等查看答案及解析
-
现有0.4 mol·L-1HA溶液和0.2 mol·L-1NaOH溶液等体积混合组成溶液。下列有关推断正确的是( )
A.若该溶液中HA电离能力大于A-水解能力,则有c(Na+)>c(A-)>c(HA)>c(H+)>c(OH-)
B.若该溶液中A-水解能力大于HA电离能力,则有c(A-)>c(HA)>(Na+)>c(OH-)>c(H+)
C.无论该溶液呈酸性还是碱性,都有c(Na+)+c(H+)=c(A-)+c(OH-)
D.无论该溶液呈酸性还是碱性,都有c(Na+)=c(A-)+c(HA)
难度: 困难查看答案及解析
-
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl。下列“水” 电池在海水中放电时的有关说法正确的是( )
A.正极反应式:Ag+Cl--e-=AgCl
B.每生成1 mol Na2Mn5O10转移2 mol电子
C.Na+不断向“水”电池的负极移动
D.AgCl是还原产物
难度: 中等查看答案及解析
-
T ℃时在2 L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图(1)所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积分数与时间的关系如图(2)所示。则下列结论正确的是( )
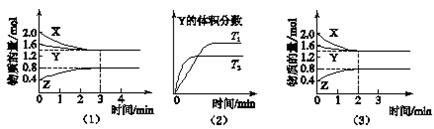
A.反应进行的前3 min内,用X表示的反应速率v(X)=0.3 mol·(L·min)-1
B.容器中发生的反应可表示为:3X(g)+Y(g)
2Z(g)
C.保持其他条件不变,升高温度,反应的化学平衡常数K减小
D.若改变反应条件,使反应进程如图(3)所示,则改变的条件是增大压强
难度: 困难查看答案及解析
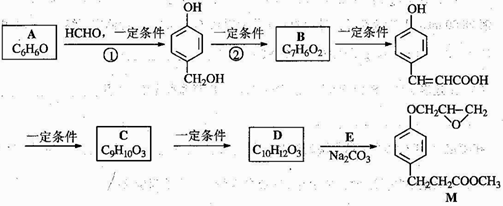
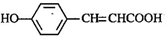 的邻位异构体分子内脱水产物香豆素的结构简式________。
的邻位异构体分子内脱水产物香豆素的结构简式________。